蛋白酶活力测定方法(福林法)
出处:按学科分类—工业技术 轻工业出版社《制革手册》第40页(2768字)
(一)原理
磷钨酸和磷钼酸混合试剂(福林试剂)在碱性条件下极不稳定,可被酚类化合物还原而呈现蓝色(钨蓝、钼蓝)。由于蛋白质中含有具酚基的氨基酸(主要是酪氨酸),蛋白酶作用于蛋白质生成含酚基氨基酸和其它的水解物,与福林试剂反应就呈现蓝色。利用这个反应特征,就可表示蛋白酶的活力。
(二)试剂制备
1.福林试剂:在2000毫升磨口回流装置内加入;
钨酸钠(Na2WO4·2H2O) 100克
钼酸钠(Na2MoO4·2H2O) 25克
蒸馏水 约700毫升
磷酸(含85%H3PO4) 50毫升
浓盐酸 100毫升
将上列化合物混合后,用温火回流煮沸10小时,然后加入硫酸锂(Li2SO4)100克,水50毫升和几滴溴水,摇匀。除去冷凝器,再煮15分钟,以除去多余的溴,溶液呈现金黄色。冷却后,在1000毫升容量瓶中稀释至刻度,过滤备用。试剂不能呈现绿色,应为金黄色。否则需再加溴水,重复处理操作。装置在棕色瓶内,使用时以试液一份加蒸馏水二份进行稀释配成1∶2福林试剂。
2.0.4克分子碳酸钠溶液:将42.4克无水碳酸钠(Na2CO3)溶解在1000毫升容量瓶中配制。
3.0.4克分子三氯乙酸溶液:将65.3克三氯乙酸(Cl3C·COOH)溶解在1000毫升容量瓶中配制。
4.磷酸缓冲液:
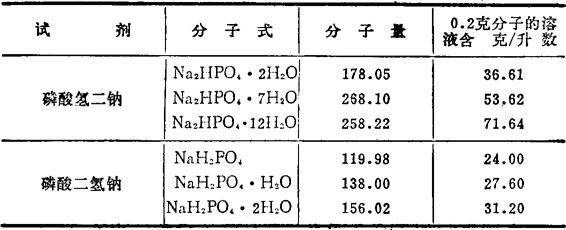
0.2克分子的磷酸缓冲液配制法(在1000毫升容量瓶中配制)。由于配制时所用试剂的结晶水不同,用量按分子量计算如表2-3。
表2-3 磷酸缓冲液配制
缓冲液的配比见表2-4。
表2-4 缓冲液的配比
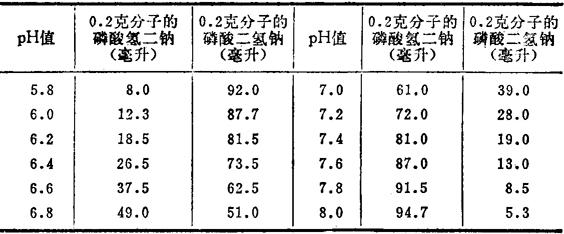
举例:取0.2克分子的磷酸氢二钠72毫升和0.2克分子的磷酸二氢钠28毫升混和在100毫升容量瓶中,测定pH值应在7.2。否则需要调正。使用时浓度稀释10倍至0.02克分子。
上例配比系按中性蛋白酶测定要求的。如果应用的蛋白酶最适pH值不在7.2,可根据情况要求,按表2-4采用不同配比的缓冲液。
5.2%乳酪素溶液:称取2克乳酪素,加1~3毫升0.5当量的氢氧化钠(NaOH)润湿,再加入约50毫升pH值为7.2的0.02克分子的磷酸缓冲液。在沸水浴中不断搅拌,使它完全溶解,冷却,再加20毫升pH值为7.2的0.02克分子的磷酸缓冲液。用0.5当量的氢氧化钠或0.5当量的盐酸调正pH值至7.2,再用0.02克分子的磷酸缓冲液在容量瓶中稀释至100毫升。然后放在冰箱中保存备用。或现用现配,以保证乳酪素溶液不变质。
(三)测定操作
在试管中加1毫升适当稀释的酶液或酶粉溶液(酶粉因活力较高,需在事前稀释,一般称重后以40℃温水溶解,再以缓冲液稀释,稀释倍数由活力高低而定),在40℃的恒温水浴中预热1~2分钟,加入已经预热40℃的2%乳酪素溶液1毫升,精确反应10分钟(自加入乳酪素溶液开始,精确计算记录时间),加入0.4克分子的三氯乙酸溶液2毫升,就终止反应。再保温10分钟等待沉淀完全,过滤。取滤液1毫升,加0.4克分子的磷酸钠溶液5毫升,加1∶2福林试剂1毫升,然后在40℃恒温水浴中显色10分钟,取出冷却。在680毫微米(mμ)下比色测定光密度(O.D.)。同时做一个空白,酶液先加0.4克分子的三氯乙酸溶液2毫升,再加2%乳酪素溶液1毫升。同样操作测定光密度。
(四)标准曲线的制备
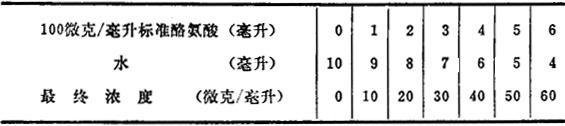
1.标准酪氨酸溶液配制方法:精确称取已烘干的酪氨酸0.1克,加入1当量的盐酸6毫升进行溶解,再用0.2当量的盐酸在100毫升容量瓶中稀释至刻度,成为100微克/毫升。稀释液的配制见表2-5。
表2-5 稀释液的配制
2.测定方法:将1毫升酪氨酸稀释液,加5毫升0.4克分子的碳酸钠,加1毫升1∶2福林试剂。在40℃恒温水浴中显色10分钟,取出冷却。在680毫微米下比色测定光密度。
根据酪氨酸的量和对应的光密度绘制曲线。求K值。
K是比色计常数,即每1°光密度所相当酪氨酸的微克数。
(五)计算
蛋白酶活力(pu)的定义为在上述条件下,每分钟由酪蛋白所生成的三氯乙酸可溶物的福林试剂呈显蓝色度与1微克酪氨酸相当时,为一个蛋白酶活力单位。计算方法如下:
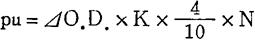
式中 ⊿O.D.=O.D.样品-O.D.空白
K=比色计常数
N=酶液稀释常数
解释:标准曲线是直接显色,而样品是由4毫升的反应液(1毫升酶液+1毫升乳酪素溶液+2毫升三氯乙酸)中吸取1毫升进行显色的,所以样品应乘以4。由于反应是在10分钟进行的,而定义是1分钟,所以要除以10(若制备标准曲线时,以酪氨酸的浓度×4为横座标,计算公式中就不需要×4)。