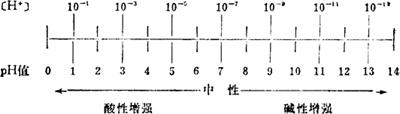
pH值的概念
书籍:制革手册
出处:按学科分类—工业技术 轻工业出版社《制革手册》第237页(966字)
pH值,又叫酸碱值;它是表示溶液的酸性、碱性与中性的一种数值。
纯水是一种极弱的电解质,它能电离出极少量的而又等量的氢离子和氢氧离子。水的电离平衡如下式:
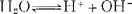
在22℃纯水中,氢离子浓度与氢氧离子浓度相等,即[H+]=[OH-]=10-7M(克离子/升)。水的离子积Kw=[H+]·[OH-]=10-14。Kw值大小与溶液中[H+]的大小无关;它随温度变化而改变。在一定的温度下,它是一个常数。在15~25℃时,纯水与任何物质的稀水溶液Kw值都是1×10-14。
根据电离平衡的同离子效应,在水中加入酸,[H+]增加,[OH-]减少,溶液中[H+]大于[OH-],溶液呈酸性。如在水中加入碱,[OH-]增加,[H+]减少,溶液中[OH-]大于[H+],溶液呈碱性。所以,在纯水、酸性及碱性溶液中H+及OH-是并存的;一种溶液的酸性、碱性与中性可用其氢离子浓度大小表示。
纯水、中性溶液 [H+]=[OH-]=10-7M
酸性溶液 [H+]大于[OH-]
即[H+]大于10-7M
碱性溶液 [OH-]大于[H+]
即[H+]小于10-7M
在酸性或碱性不很强的溶液中,氢离子浓度数值太小,不便直接表示,故采用pH值表示。pH值是溶液氢离子浓度的常用对数的负值,即pH=-log[H+]。如纯水的[H+]=0.0000001M=10-7M,纯水pH=-log(1×10-7)=7。
酸性溶液的pH值小于7;pH值愈小,酸性愈强。碱性溶液的pH值大于7;pH值愈大,碱性愈强。