硝酸银滴定法(莫尔法)
出处:按学科分类—农业科学 农业出版社《土壤农化分析手册》第370页(1344字)
1.适用范围 本法应用较广,方法简便,滴定须在中性或微碱性介质中进行,尤其适用于盐渍化土壤的Cl-离子测定。
2.试剂配制
(1)5%铬酸钾指示剂:铬酸钾(K2CrO4)5g溶于少量水中,滴加饱和的AgNO3溶液,直到出现棕红色Ag2CrO4沉淀为止,在避光处放置24h,过滤除去Ag2CrO4沉淀,将滤液稀释至100ml,贮于棕色瓶中备用。
(2)0.03N硝酸银标准溶液:准确称取经105℃烘干的AR AgNO35.097g溶于蒸馏水中,移入容量瓶后加水定溶至1L,摇匀,保存于棕色瓶中。必要时用0.0400NNaCl标准溶液标定。
(3)0.0400N氯化钠标准溶液,准确称取约105℃烘过的AR NaCl 2.338g,溶于水后再加水定容至1L。摇匀。
3.测定步骤 吸取浸出液25ml(或用滴定碳酸盐和重碳酸盐后的溶液继续测定Cl-),用饱和NaHCO3溶液或0.1NH2SO4溶液调至酚酞指示剂红色刚褪去(即使溶液pH达中性或微碱性)。向溶液中加5滴K2CrO4指示剂,用标准AgNO3滴定至出现棕红色沉淀并不再消失为止。滴定时须剧烈振荡,以防终点早到。
4.结果计算

式中:V——滴定时所消耗AgNO3的体积;
N——AgNO3的当量浓度;
0.0355——每1毫克当量氯离子的克数。
5.注释
①用铬酸钾做指示剂,K2CrO4的浓度应在0.0025-0.005M之间。且反应只能在中性或微碱性溶液中进行,即测定溶液应在9.5-10.5之间。因为在酸性溶液中会发生如下反应:

降低了CrO4=的浓度,影响Ag2CrO4沉淀的生成。如在强碱条件下,则会产生如下反应:
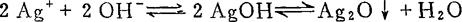
影响分析结果。故在滴定前一般须调至pH≈7。
②浸出液如有颜色影响滴定终点判断时,可用稀硝酸酸化后的活性炭脱色(最后滤液要用NaOH中和);或者将浸出液蒸干,用过氧化氢去除有机质的颜色,再用蒸馏水溶解后进行测定,或者用电位滴定法测定。
③氯离子含量太高时,因生成白色氯化银沉淀过多而影响终点。如所取浸出液中的Cl-超过2.5mg,此时应酌情减少浸出液吸取量。并于稀释后测定之。
④大量硫酸盐存在会干扰测定,当浸出液中硫酸根离子存在量在32mg以下时,对本测定一般无干扰。