禾本科饲草
出处:按学科分类—生物科学 农业出版社《植物细胞培养手册》第480页(14542字)
饲料草类是天然牧场和重播草地的主要组成。世界上乳、肉和毛生产基本上依赖于草类和豆科植物混合体,其中草类是动物生长和发育的主要能源。所以,培育高产优质饲料草类品种是提高动物生产的关键。现代家畜管理趋向是:增加家畜数量,节省饲草(干草和青贮饲料)和适于特殊目标的草类栽培品种。干物质质量如可消化率也很重要。
最重要的温带草类是:小麦草、无芒雀麦、鸭茅、高秆田边草、多花黑麦草、黑麦草、早熟禾、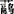 草、狗牙根、羊草、紫狼尾草、苏丹草、石茅高粱,Paspalum notatum Flugge,Pennisetum clandestinum Hoschst exchiov 。
草、狗牙根、羊草、紫狼尾草、苏丹草、石茅高粱,Paspalum notatum Flugge,Pennisetum clandestinum Hoschst exchiov 。
许多禾谷类和杂谷作物广泛用做青饲料,干草和青贮饲料。包括燕麦、大麦、黑麦、高粱、珍珠粟和玉米,还有甘蔗,尤其是蔗顶用做青饲料或切碎青贮。野生甘蔗作牛粗饲料。小麦栽培品种在一定限度内也用于制作干草和青贮饲料。
几乎所有温带草类基础染色体数x=7。热带和暖季地区有x=8,9和10的种。二个地区都普遍存在多倍体,在进化上有重要作用。一般言之,二倍体种染色体相对较大于其有关多倍体和染色体数较多的无亲缘关系种。
(一)组织培养技术应用于草类育种
草类栽培品种的常规育种技术由四个阶段组成:(a)收集群体和产生变异,(b)选择需要变异体,(c)评价选择的变异体,以证明其优性和(d)选出的和供试基因型的繁殖和推广栽种。组织培养可作为其补充技术,尤其对(a)和(b)阶段可做到省时、省工和省钱。
采用组织培养技术,可从多种途径取得变异体:包括从叶组织、芽、胚的愈伤组织和细胞培养体自发的和诱导突变,如x射线,γ射线,中子或化学诱变剂,如乙烷甲烷磺酸或秋水仙素(加在培养基中),以及细胞融合和细胞转化和原生质体融合。可从植株的任何分生组织启动培养体。在花卉培养中,用芽培养和辐射技术已产生了许多变异体,禾谷类作物尚待开发。
组织培养技术的成功,有主要几种步骤:(a)能常规建成无菌培养体,(b)建成的培养体能以克隆和经继代保持,(c)大量产生再生植株,(d)移栽成活高和(e)再生植株至少部分可育,产生足量花粉和种子,以供繁殖。后者对营养繁殖草类并不重要。
禾本科作物的无菌培养体虽于40年代取得成功,直到60年代后期(禾谷类)和70早年期(饲草类)从愈伤组织才能以成功。早在1949年,LaRue建成玉米胚乳培养体。Norstog(1956)切取多年生黑麦草发育中种子胚乳培养,持持了2年半以上。Norstog(1956)和Nostog等(1969)报道了培养的细胞染色体数和结构变化(后期桥形)。但未见器官建成。同样,Schenk和Hildebrandt(1972)和Atkin和Barton(1973)从几种温带饲草颖果建成愈伤组织培养体,未得再生。Gamborg等(1970)从光叶雀麦草无芒雀麦再生植株成功,是白化苗。同样,多花黑麦草花药愈伤组织再生植株也是白化苗。1967和1974年间,几种禾本科作物从愈伤组织培养再生成功。其中有水稻,小麦,高粱,芦粟和甘蔗杂种。1975年报道了玉米和黑麦草大规模植株再生。白此许多饲草种愈伤组织培养再生成功。同样许多禾谷类愈伤组织培养也能再生。
1.建成愈伤组织培养物和植株再生 大多数饲草(表20-11)可从任何分生组织诱导愈伤组织,例如:茎尖分生组织和幼叶,发育中胚和颖果,幼花序,胚乳和花药。大多数采用诱导愈伤组织培养是只加2,4-D的MS和LS。继代后生长和增殖需降低2,4-D水平或增加生长调节剂。诱导用2,4-D用量为2.3-67.8μM,视培养的组织和种而定。多年生黑麦芽胚乳愈伤组织诱导,采用WH培养基附加IAA5.7μM+CW20%或酵母浸出液0.25%,不加2,4-D。对诱导饲草产生愈伤组织,与2,4-D一起加IAA,KIN,(W和YE并无必要。加低到6.47μM KIN,对小麦、大麦、水稻和雀麦草诱导愈伤组织有抑制作用和许多饲草。同样,Lo等(1980)报道在含有2,4-D培养基加KIN不能促进愈伤组织启动。
表20-11 青刈饲草的愈伤组织诱导
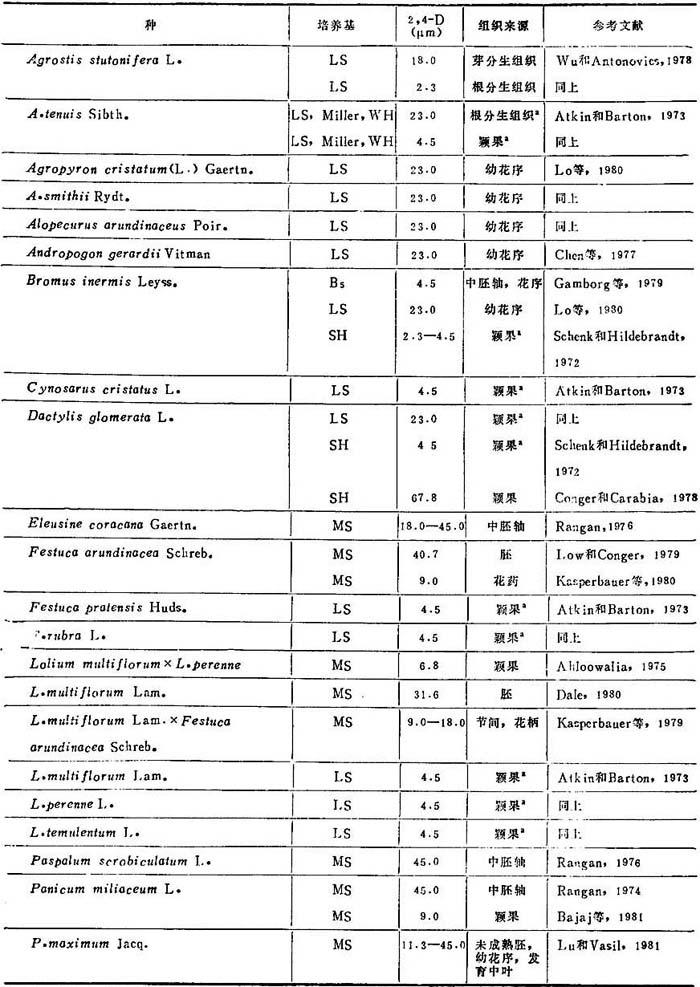
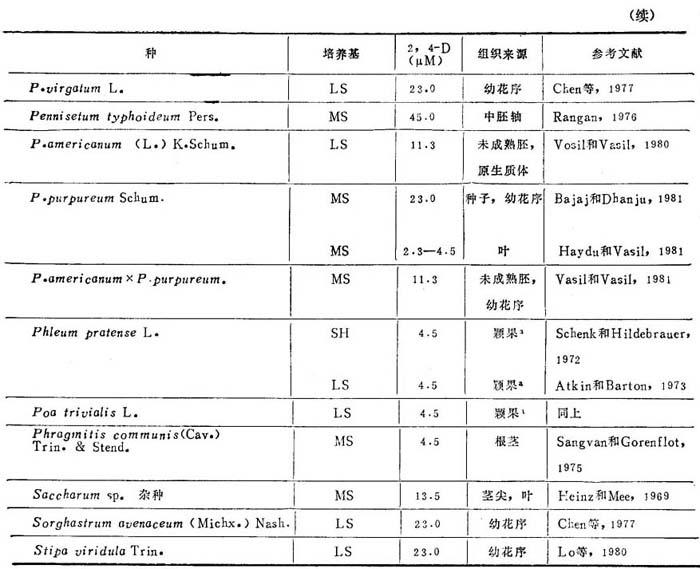
a.只有愈伤组织,未能再生植株。
愈伤组织生长和增殖所需2,4-D和其它营养浓度较低于诱导培养基。这样状态或用延长愈伤组织继代时间或用转移到2,4-D降低的1/2强度培养基中来达到。大多数饲草愈伤组织培养体生长和增殖加2,4-D4.5-9.0μM已能满足。
通常是无组织块的愈伤组织培养体,常分化成各种细胞类型,可能经克隆产生更多愈伤组织,或引发产生芽、根和体细胞胚(胚状体),终而生长成株。如果愈伤组织在产生芽原基前生根,就很不可能将再发育成芽原基。
日益增多论证指出,虽可用相同基础培养基诱导愈伤组织、增殖,器官建成和植株再生。但所需生长素与KIN和其它生长调节剂用量和比率不同,且为愈伤组织生长和分化不同时期的关键。例如,2,4-D对愈伤组织诱导和增殖虽有重要作用,但器官建成和形成再生植株并不需要。一般言之,相对高生长素和低浓度KIN(例如,用于黑麦草2,4-D6.8μM,IAA37.1μM和KIN10.2μM),促进着愈伤组织诱导和增殖。另一方面,高水平KIN(4.6μM)和低生长素(2,4-D2.3μM)用于Lolium spp.促进芽形成。为了体细胞胚胎发生,对生长素需要水平较低于芽器官建成。完全除去2,4-D,常导致已进行器官建成的愈伤组织培养体形成植株。
草类任何分生组织都有可能启动愈伤组织培养体,但并都有再生植株能力。一般来说,未成熟胚产生的愈伤组织培养体,植株再生率最高;降低2,4一D水平(2.3μM),降低培养基强度(1/2强度)和延长培养期间可促进分化和器官建成。附加其它生长调节剂如玉米素,也能促进草类的器官建成。
几种禾本科作物曾从愈伤组织培养体再生成功,例如甘蔗,水稻,小麦,T.durum L.,玉米,大麦,燕麦,高粱,Ponicum miliaceum L.(Rangan,1974),珍珠粟和小黑麦,以及几种饲草。
饲草再生首次成功的可能是一组热带草种。Urata和Long(1968)报道了Brachiaric ruziziensis Germain & Evrard,Digitaria decumhensStent,甘蔗,野生蔗等草类愈伤组织培养在含无机盐类,蔗糖,琼脂,CW和2,4-D培养基上。这种愈伤组织进行器官建成,长成芽原基,转到无2,4-D培养基后,产生完整植株。还说组织培养可用于繁殖不育杂种,用秋水仙素处理愈伤组织可诱导产生双倍数体。
Heinz和Mee(1969)用甘蔗、野生甘蔗和甘蔗属杂种茎尖、叶和花序建成愈伤组织培养体。这是在附加2,4-D13.6μM+CW10%(v/v)的MS诱导产生的。转到不加2,4-D培养基后,产生植株分化。有些再生植株是亲本克隆的形态变异体,由此建立着草类通过愈伤组织培养产生新基因型的可能性。
随着热带草类的成就,Gamborg等(1970)从全叶雀麦草的冷季草种悬浮培养体再生成功,但都是白化苗。这或者是首次饲草种悬浮培养体取得的体细胞胚胎发生。Schenk和Hildebrandt(1972)将未成熟种子培养在2,4-D2.3μM+p-氯苯氧乙酸10.7μM+KIN0.46μM启动愈伤组织培养体。培养加2,4-D4.5μM液体悬浮体中,28℃,暗培。用无2,4-D的B5培养基洗培养的细胞,旋转振荡150rpm,28℃,B5培养基。2周内,当转移到B5固化培养基上,培养在18/6h光/暗周期,15/18℃,这些悬浮培养体产生体细胞胚。30天内出现几打白化再生植株。
饲草再生的成就为其它饲草类创建着愈伤组织和细胞培养的趋向(表20-11)。1975年期间,四位学者同时报道禾本科愈伤组织再生植株:黑麦草,大麦,芦苇,和玉米。每个种愈伤组织诱导都发生于附加减量2,4一D或不加2,4-D培养基,从而得到植株再生。黑麦草愈伤组织是把未成熟胚接种在MS+2,4-D6.8μM+IAA37.1μM+KIN10.0μM诱导产生,用1/2MS+2,4-D3.4μM+IAA21.4μM+KIN5.0μM再生植株。加CW(1ml/l)促进愈伤组织培养体芽器官发生和产生叶绿素。大麦茎尖分生组织接种在MS+IAA10μM+2,4-D15μM+2ip1.5μM诱导愈伤组织,在同样培养基不加任何生长调节剂取得了再生植株。在含有IAA和2ip培养基中加NAA20μM促进愈伤组织增殖;但2ip对保持愈伤组织还不能肯定。
Sangwan和Golrenflot(1975)用四倍体(2n=4x=48)和八倍体(2n=8x=96)芦苇根茎接种在MS+2,4-D4.5μM。他们也采用2,4-D2.3-45.2μM,在2,4-D2.3-13.6μM培养基产生了愈伤组织。激动素不能加强愈伤组织形成,KIN4.6-9.3μM反有抑制。高水平KIN减少愈伤组织生产。在KIN0.46μM+CW5%(v/v)培养基上发生器官分化。不加生长素的观察到器官建成(芽形成)频率最高。IAA22.8μM+KIN0.93μM促进生根。愈伤组织对蔗糖浓度要求较高(0.12M)。建成了悬浮培养物,培养5周产生小团块,后来只生根。都未见体细胞胚。
Green和Phillips(1975)把玉米未成熟胚培养在MS+2,4-D9.0μM培养基上,诱导愈伤组织培养体;用同样MS+2,4-D1.13μM发生芽器官发生和叶,不加2,4-D形成了再生植株和根。当将愈伤组织继代在MS+NAA5.4μM+2ip0.24μM,叶器官建成和发育有所促进。
这些报告发表后,报道了许多饲草再生植株:例如鸭茅,Andropogon gerandii Vitman,Agrostis stolonifera L.,A.palustris Huds.,Sorghastrum rutans(Michx.)Nash.,高秆田边草Festuca arundinacea Schreb.,黑麦草×高秆田边草杂种,多花黑麦草,苇状青麦娘冰草,无芒雀麦,洋醉马草,史氏偃麦草和紫狼尾草。还有几种饲料草,例如燕麦,高粱和珍珠粟。这些青刈饲草和饲料草类需要附加2,4-D与IAA或不加IAA以诱导愈伤组织,不加或减少用量取得再生植株(表)。
Gamborg等(1970)首次报道从雀麦草属愈伤组织培养体的体细胞胚胎发生取得再生植株。自后为许多种的培养结果所证实:即黑麦草属,多花黑麦草,高粱,珍珠粟,珍珠粟×紫狼尾草杂种,羊草,玉米和甘蔗。与分散在愈伤组织中的绿色分生组织区域的芽原基相反,体细胞胚出现二极结构,在愈伤组织培养体表面上,启动盘状结构。培养基附加低水平生长素和高浓度蔗糖促进体细胞胚胎发生。
2.愈伤组织培养体中变异来源 愈伤组织培养体的遗传组成发生“自发”变化。可能包括细胞质结构,如质体和线粒体或染色体。可能由于突变或不对称细胞分裂而发生。染色体变化包括染色体获得、丢失,折断和再接合(移位),以后通过核内有丝分裂或细胞融合使染色体数增多。愈伤组织继代中,细胞可能发生核融合,由此增加染色体数,更由于丢失染色体产生非整倍体,因而产生一系列变异体。黑麦草愈伤组织培养体曾发现这种变异类型,5年内再生了4000株以上。三倍体愈伤组织(2n=21)的白化突变部分再生白化植株,而绿色部分产生绿色植株。再生植株染色体数范围,即2n=21,20,19,18,15,40,30,29,28,27和26,都来源于亲本植株2n=21。有些非整倍体植株出现染色体易位。硬粒小麦2n=4x=28的愈伤组织再生植株,观察到同类染色体变化,其染色体数2n=14-56。其它几种草种组织培养再生植株亦然,如甘蔗,水稻,黑麦草×田边草杂种。在同一块愈伤组织再生植株中,常见明显表型差异,或者代表着基因型。如黑麦草和小麦。常能引发愈伤组织产生体细胞胚,可能来自单细胞,以及可能包括新变异体。
3.胚培养和远缘杂交 自然基因库中不存在的新奇变异,可从异种和异属杂种中产生。青刈饲草育种家曾从几属中取得这类杂种。胚培养是植物育种家取得异种和异属杂种所用的最早技术之一。而用常规杂交不能产生成活子代。E.Hannig首次采用胚培养。早在1934Tukey报道落叶果树胚培养。1945年Randolph改进完善胚培养,用Iris产生再生植株,Lammerts(1942)用胚培养缩短落叶树育种周期,增进杂种种子发芽。Keim(1953)把胚培养成功地用于几种饲草豆种杂种。这些研究清楚地建立了,在大多数情况下,发育中胚与其胚乳的营养的、生理的和遗传的不亲和性,导致早期合子致死,可用胚培养来克服。青刈饲草和有关禾谷类的若干异种和异属杂交失败,可归之于合子前和后障碍。即使是种内,亲本植株染色体数(倍数性)产生早期胚死亡;例如,黑麦草中二倍体×四倍体杂交,除非用发育中的胚进行培养,很少产生三倍体。
近年来胚培养技术有新发展,十年前认为不可能取得的一系列远缘杂交产生了杂种。异属杂交如大麦×黑麦,大麦×小麦,大麦×一粒小麦,大麦×圆锥小麦和三属杂种:大麦×小麦×黑麦,曾用GA3活体处理授粉小花和离体发育中胚人工培养取得成功。有些情况远缘杂交成功归因于免疫抑制剂如E-氨基己酸或氯霉素(1974),其它由于生长调节剂如IAA,GA和2,4-D在受精前和后处理。禾谷类远缘杂交中,经约30年营养繁殖后,用小麦或黑麦给大麦授粉后,曾用GA处理。常规杂交产生的异属甘蔗×玉米杂种,经GA处理诱导出现完全花序。黑麦草×紫羊茅经子房培养产生杂种植株。最近用胚培养技术取得了苇状羊茅×鸭茅杂种。
禾谷类和草类大多数远缘杂交完全不育。其它在其后代中染色体丢失,常是一个亲本的染色体丢失比其它亲本为多。在某些情况下,能诱导这些不育杂种产生愈伤组织,并再生植株。此外,无论施加任何处理与否,这类杂种的愈伤组织培养体,产生一系列染色体变异体,如甘蔗杂种,多花黑麦草×黑麦草或用秋水仙素处理大麦×芒麦草。异种间杂种和Tritieum crassum〔(Bviss.)Aitch和Hensl〕×大麦异属杂种的愈伤组织。
4.细胞和原生质体培养 现在已易于将某些草种培养于液体培养基中,并取得悬浮培养体中的单细胞或细胞小团,例如无芒雀麦,黑麦草属和珍珠粟,羊草。但是,大多数草类单细胞培养体对植株再生反应与典型双子叶植物如胡萝卜、烟草、矮牵牛和马铃薯不同。至今狼尾草属和黍属是最成功例证,二者都是用未成熟胚取得细胞悬浮培养物的,经由体细胞胚胎发生产生植株。
采用酶法去细胞壁产生原生质体使细胞培养技术更为改进。原生质体培养已成功地应用于再生几种异种杂种植株。至今还未能用原生质体融合产生青刈饲草和禾谷类的远缘体细胞杂种。但是,珍珠粟报道了原生质体培养再生植株,可知这种方法不久可能被采用。
综观今用常规有性杂交很难产生有价值的远缘杂种,当前体细胞杂种可能不会产生有重要经济价值的栽培品种。但是,包括供体种细胞质融合的体细胞杂种,即使在原生质体融合后大部分核遗传物质丢失,仍有可能提供一系列有用的新变异体,这是有性杂交所不能产生的。草类应用DNA转移和细胞修饰尚无所知,这种技术对常规草类育种有明显影响前,还要做很多研究。
5.花药培养 如果组织培养技术能产生变异,其保存同质性必能大为加速,省时省工。不像禾谷类,青刈饲草是异花授粉,同质性不如对育成纯系品种那样重要。虽然如此,为了产生供选择特定性状的纯合亲本品系和开发杂种优势,同质基因型是必需的。
花药和小孢子培养再生单倍体,不仅能加速同质性,也能创造遗传变异体。
青刈饲草花药培养产生单倍体的不普遍。一年生黑麦草花药培养第一次得到白化单倍体。花药接种在LS(1965)+蔗糖0.35M+CW15%+NAA5.4μM。约20%花药形成愈伤组织,其中3%形成白化植株。四倍体(2n=4x=28)多花黑麦草花药培养取得一株双单倍体(2n=14)(Nitzsche,1970)。此后,从多花黑麦草(4x)×苇状羊茅(12x),牛尾草(2x)×多花黑麦草(4x)和牛尾草(4x)×多花黑麦草(4x)杂种花药培养再生成功(多)单倍体植株。但是,成功率极低;培养了55000以上花药只得15株,其中4株是白化苗。同样,培养了约65000燕麦花药只取一株单倍体(2n=3x=21)。最近Kasperbouer等(1980)培养高秆田边草(2n=6x=42)穗上花药再生了单倍体。穗切段接种在改进的MS+2,4-D9.0μm培养基上,一旦形成再生植株,将2,4-D减少到1.1μm。把穗放在低温5℃预处理0-34天,继之把预处理2周后的离体花药培养N6培养基上,也产生了高秆四边草的绿苗和白化苗,二者都有非整倍体。
由于一些草类是无配生殖的(例如Poa),已知其它可经未减数卵细胞产生植株,培养整体子房对取得同质基因型有价值。从未受精胚珠和胚培养将可取得母性遗传性状,由此可能在遗传上与从小孢子再生的单倍体不同。但是,青刈饲草还未进行过这类研究。还有有性杂交与组织培养技术相配合产生单倍体,像大麦杂交大麦×球茎大麦中球茎大麦染色体组发生选择性丢失,也未曾用于青刈饲草。
6.选择 组织培养中,可在细胞、愈伤组织或再生植株水平上进行选择。目前很少特性曾在细胞水平进行过选择。在小空间里能生长极多细胞和再生植株,采用组织培养选择某些性状的效率比常规田间选择为高。再者,调节生长培养基,可为从愈伤组织里筛选细胞提供有效快速方法。曾对病原菌毒素抗性和抗逆性建立了选择方法。在含有Pseudomonas tabaci产生的毒素类似物蛋氨酸sulfoximine培养基上筛选的烟草细胞的再生植株,表现抗性增高。它受一个半显性基因的支配。Gengenbach等(1977)选择玉米细胞系,能抗南方玉米凋萎病(Helminthosporium maydis小种T)〔来源于texas雄性不育细胞质(cms-T)基因型,对这种病原菌有感病性〕。再生植株具有抗病性。
Dix和Street(1975)指出有可能从林烟草和辣椒选出耐盐细胞系,有在0.34M NaCl中生长能力。增高培养基的铜和锌用量,Wu和Antonovics(1978)选出了高耐的匐茎翦股颖的细胞系。其再生植株表现对铜和锌相同水平耐性。同样,Fitch和Moore(1981)报道了甘蔗耐盐性选择。愈伤组织的再生植株接种在含NaC10.31或0.34M的改进的MS上。取生存再生植株再培养在含NaCl0.20-0.34M培养基上,表现耐盐,大田试验证明有抗盐性。其它特性如增高除莠剂耐性,盐碱、寒冷、热和增高光合作用,在将相应的化合物加入生长培养基,或将培养体放在选择的生长条件,都可进行人工培养下选择。隐性核和细胞质性状,在单倍体水平进行选择,更为有效。
7.无性系保存和种子繁殖 现已可能用分生组织培养增殖和储存克隆几种草类,如黑麦草、田边草,梯牧草和果园草。人工培养繁殖率远较钵栽和大田为快。还能保持无性系无病毒和病虫害。即使用大田带病毒克隆,可用热处理和分生组织培养加以消除。如黑麦草已获成功。在一些情况下,组织培养是从病毒侵染植株取得健全克隆的唯一方法。
离体培养繁殖的无性系生长更一致,无虫无病毒,移植生长更好(与常规繁殖植株相比)。采用离体培养保持草类无性系,为草类育种方案提供着最简便和有用方法,因为克隆后代进行测试前,需经3年以上的繁殖,此时必需在大田保持亲本基因型,供再杂交产生第一世代种子。
(二)培养程序
1.草类胚愈伤组织诱导
(1)开花后10-12天收割整花序。
(2)用自来水淋洗花序,用漫着95%乙醇的组织纸擦小花表面。
(3)把花序切成长2-3cm小片,取出种子(仍带有外颖和内颖)。
(4)浸入无菌水4-6h或过夜。
(5)除去内、外颖,用无菌水稀释(1∶4v/v)的Clorox(或5%次氯酸钠)表面消毒种子10-15min。再用95%乙醇速蘸(1-3秒)表面消毒各粒种子,浮在无菌蒸馏水中。为了避免交叉感染,把单粒种子分开放在培养皿水滴上。
(6)从大粒草种解剖取出胚。小粒草种则取完整颖果培养在加2,4-D培养基上。2,4-D用量视种而异。6-10天内启动愈伤组织培养体,继代前可再保持30天。
2.细胞悬浮培养体
(1)从未成熟胚(约1cm3)诱导产生的愈伤组织小块,放入装50ml液体培养基附加2,4-D(低水平,0.45-0.9μM)+CW的150-200ml三角瓶中。
(2)放在旋转振荡器上,150rpm6-10天,15℃,暗培。
(3)取下三角瓶,静置半小时。
(4)倒去上半部上清液。
(5)用预先消毒的不锈钢筛过滤余下的悬浮培养物。大块愈伤组织停留在上层,悬浮细胞下沉。
(6)将滤过液离心100×g3min,用巴斯德吸移管除去上清液。
(7)加新鲜培养液,达到规定体积。测定每ml培养液的细胞数。调节密度为10000-15000细胞/ml。将细胞植板在固体培养基小滴上,培养基附加CW 1%+ZEA 9.1μM+2,4-D2,3μM,封口,倒置培养在扩散光下。14天后观察克隆形成。为了选择耐盐性,采用加NaCl0.03-0.05M的培养基。
(8)有些细胞团可能产生体细胞胚胎发生,并出现许多芽原基。把选出的再生植株再接种在选择培养基上(即高浓度盐).取生存再生植株再培养30天以上,然后移栽入土。
3.草类原生质体分离和培养
(1)取4-6日龄细胞悬浮培养体10m1(法见胚愈伤组织诱导节)。
(2)与50ml过滤消毒的未脱盐酶混合液相混和。酶混合液组成:2%纤维素酶,1%macerozyme,0.5%driselase,0.5%Rhgzyme,甘露糖醇0.25M,山梨糖醇0.25M,葡萄糖1.38mM,MES缓冲剂3mM,溶于不加生长调节剂的LS培养基中。
调节pH5.5-5.6。
(3)暗培,15℃,15-20h。
(4)用纱布过滤混合液,再用100和50μm不锈钢筛过滤。
(5)倒入离心管,100×g3min。除去上清液。加5mlMS+葡萄糖0.4M+蔗糖3.5mM+2,4-D45μM;再离心。这种过程反复3次,除清酶液。
(6)使片状沉积物到规定体积约4-5ml。轻度振荡打碎片状沉积物。
(7)将原生质体植板在固体培养基上。
(三)结论和展望
关于草类改良的概括论述,提出组织培养技术可能为创造变异,人工培养选择若干性状和繁殖无病克隆提供新途径。这种技术只有常规育种方法的补充而不是代替。组织培养技术在取得广泛变异,消除异种和异属杂交障碍,或经有性杂交和胚培养,或通过体细胞杂交,很可能有重要作用。培养发育中的胚,或是直接地或经愈伤组织、细胞和原生质体培养产生再生植株,可缩短育种和选择过程,如用离体培养选择耐逆性。目前,体细胞融合和植株再生,对草类育种的贡献不大。但采用组织培养可省时,省工和省地,可能缩短育成新栽培品种所需年限。由此,育种家运用组织培养技术,立即可增进常规培育草类栽培品种的推广速度,还能及时地为常规育种提供新奇重组体,这是后者所未曾得到过的。
【参考文献】:
〔1〕Carnhan,H.L.and H.D.Hill 1961 Cytology and genetics of forage grasses。Bot.Rev.27∶1-162.
〔2〕Heath,M.E.,D.S.Metcalfe and R.E.Barnes 1973 Forages∶The Science of Grassland Agriculture.3rd ed.Iowa State Ulniv.Press,Ames.
〔3〕Larkin,P.J.and W.R.Scowcroft 1981 Somaclonal Variation-Anovel source ofvari ability from cell cultures for plant improvement.Theor.App.Gonct,60∶197-214.
〔4〕Schenk,P.J.and A.C.Hildebrandt 1972 Medium and techniques for induction and growth of monocotyledonous and dicotyledonous plant cell caltures,Can.J.Bot.50∶199-204.
〔5〕Thomas,E.,P.J.King and I.Potrykus 1977 Shoot and embryv.like structure formation from cultured tissues of Sorghum bicolor.Naturwissenschaffen 64∶587.
〔6〕Brenneman,F.N.and A.W.Galston 1975 Experimentson Cultivation of protoplasts and calli of agriculturally important plants.1.Oats(Avena Sativa L.).Biochem.Physiol.Pflanz.168∶453-471.
〔7〕Cummings,D.P.,C.E.Green,and D.D.Stuthman 1976 Callus inductionand plantregeneration in oats.Crop Sci.16:465-470.
〔8〕Flores,H.E.,R.Kaur-Sawhney and A.W.Calston 1981 Protoplasts as vehicles for plant propagation and improvement.In∶Advances in Cell Culture(K.Maramorosch,ed.)pp.241-279,AcademicPress,New York.
〔9〕Galston,A.W.and K.Kaur-Sawhney 1980 Polyamines and plant cells.What’s New Plant Physiology,11∶5-8.
〔10〕Loerz,H.,C.T.Harms,and I.Potrykus 1976 Regeneration of plants from callus in Avena sativa L.Z.Pflamzcnziiecht.77∶257-259.
〔11〕Dunstan,D.L.,R.C.Short,H.Dhaliwal and E.Thomas 1979 Further Studies of plantlet production from cultured tissue of Sorghum bicolor.Protoplasma 101:355-362.
〔12〕Green,C.E.and R.Phillips 1975 In vitro Plant regeneration from tissue cultures of maize.CropSci.15∶417-421.
〔13〕Lu,C.Y.,V.V asil and I.K.Vasil 1981 Isolation and Culture of protoplasts of Panicum maximum Jacq.(Guines grass)∶Somatic embryogenesis and plantlet formation.Z.Pflanzenphysiol.104∶311-318.
〔14〕Vasil,V.and I.K.Vasil 1980 Isolation and cultrre of cereal protoplasts,Part2.Embryogenes and plantlet formation from protoplasts of Pennisetum american umn Theor.Appl.Genet.56∶97-99.
〔15〕Vasil V.1982 The ontogeny of somatic embryos of Pennisetum americanum(L.)K.Schum.I.In:caltured immature embryos.Bot.Gaz.143∶454-465.
〔16〕Bingham,E.T.1980 Maximizing heterozygosity in autotetraploids.In∶Polypl-oidy Biological Revevance(W.H.Lewis.ed.)pp.471-489,Plenum Press,New York.
〔17〕Hurley,L.V.D.M.Kantz and J.W.Saunders 1975 Breeding alfalfa Which regenerates from callus tissue culture.Crop Sci.15∶719-721.
〔18〕Kao,K.N.and M.R.Michayluk 1980 Plant regeneration from mesophyll protoplasts of alfalfa.Z.Pflanzenphysiol.96∶135-141.
〔19〕McCoy,T.J.and E.T.Binghim 1977 Regeneration of diploid alfalfa plants from cells grown in suspension culture.Plant Sci Lett.10;59-66.
〔20〕Walker,K.A.and S.J.Sato 1981 Morphogenesis in callus tissue of Medibago sativa.The role of ammonium ion in somatic embryogenesis.Plant cell,Tissue and Organ Culture.1∶109-121。