食品中d-,dl-酒石酸及其盐类的测定方法
出处:按学科分类—工业技术 中国轻工业出版社《食品添加剂分析检验手册》第16页(3286字)
化学名:2,3-二羟基丁二酸(d-,dl-Tartaric Acid)
结构式∶ HOC
HOCHCOOH
分子式:C4H6O6·nH2O(结晶品n=1,无水品n=0)
相对分子质量:结晶品168.11,无水品150.09
d-,dl-酒石酸盐类:
化学名:d-,dl-酒石酸钠(Sodium d-,dl-Tartrate)
结构式:

分子式:C4H4Na2O6
相对分子质量:194.05
化学名:d-,dl-酒石酸氢钾(Potassium d-,dl-Bitartarte)
结构式:
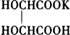
分子式:C4H5KO6
相对分子质量:188.18
一、dl-酒石酸的鉴别
1.旋光性试验
称取试样1g,加水10mL溶解,按GB/T613的规定进行测定,应无旋光性。
2.酸碱性试验
称取试样1g,加水10mL溶解,用蓝色石蕊试纸测试,应呈红色。
3.酒石酸盐的反应性试验
3.1 试剂和溶液。
3.1.1 硝酸;
3.1.2 硫酸;
3.1.3 氢氧化钠溶液:40g/L;
3.1.4 硝酸银溶液:20g/L;
3.1.5 氨水溶液:2→5;
3.1.6 乙酸溶液:1→4;
3.1.7 硫酸亚铁溶液:80g/L;
3.1.8 过氧化氢溶液:1→10;
3.1.9 间苯二酚溶液:20g/L;
3.1.10 溴化钾溶液:100g/L。
3.2 操作步骤 称取试样5g,加少量水溶解,再用氢氧化钠溶液中和至中性,加水至100mL,作为样品溶液A。然后按下述方法进行。
3.2.1 加硝酸银溶液于样品溶液A中,生成白色沉淀。分离该沉淀,加硝酸于其一部分时,沉淀即溶解。加氨水溶液于另一部分并加温,沉淀溶解且应慢慢生成银镜。
3.2.2 加乙酸溶液2滴,硫酸亚铁溶液1滴,过氧化氢溶液2~3滴及过量的氢氧化钠溶液于样品溶液A中,即显红紫~紫色。
3.2.3 在预先加有间苯二酚溶液2~3滴及溴化钾溶液2~3滴的5mL硫酸中加入样品溶液A2~3滴,于水浴上加热5~10min,溶液应显深蓝色,冷却后,注到过量的水中时,显红色。
二、dl-酒石酸含量的测定
1.方法提要
试样(先经干燥)的水溶液,在酚酞指示液存在下,用已知浓度的碱标准滴定溶液滴定,测出试样的总酸度(以C4H6O6计)。
2.试剂和溶液
2.1 氢氧化钠标准滴定溶液 c(NaOH)=0.1mol/L。
2.2 酚酞指示液10g/L。
3.测定方法
3.1 结晶品的样品处理 称取试样约5g,精确至0.0002g,置于已恒重的带盖称量瓶中,于105~110℃的烘箱内干燥物B。
3.2 测定方法 结晶品:称取3.1条中干燥物B约2g,精确至0.0002g;无水品:称取干燥品约2g,精确至0.0002g,用水溶解,移至250mL容量瓶中,稀释至刻度,用移液管移取25mL于250mL锥形瓶中,加酚酞指示液2~3滴,用氢氧化钠标准滴定溶液滴定至微粉红色,保持10s不褪色为终点。同时作空白试验。
4.分析结果的表述
dl-酒石酸(以C4H6O6计)的含量以质量分数(w)表示,按式(1-9)计算:

式中 V1——试样消耗氢氧化钠标准滴定溶液的体积,mL
V2——空白试验消耗氢氧化钠标准滴定溶液的体积,mL
c——氢氧化钠标准滴定溶液的实际浓度,mol/L
m1——试样质量,g
0.07504——每毫摩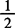 C4H6O6的质量,g/mmol
C4H6O6的质量,g/mmol
5.允许差
两次平行测定结果差值不大于0.2%,取其算术平均值为测定结果。
三、食品中d-、dl-酒石酸及其盐类的测定方法
气相色谱法
1.原理
食品中的酒石酸及其盐类,依测定酒石酸的三甲基甲硅烷基本的气相色谱法进行定量。按需要乘以相对分子质量比而求得酒石酸钠和酒石酸氢钾的量。
由于食品中存在天然的酒石酸,所以测定值应为食品中天然和添加的酒石酸总量。
2.测定方法
采用本章第二节“三、柠檬酸及其盐类测定方法”的气相色谱法(包括试剂、样液等)。仅将文中的“柠檬酸”改为“酒石酸”,测定条件中的柱温180℃改为140℃。计算按式(1-10)进行。

式中 ρ——样品液中的酒石酸浓度,μg/mL
m——样品质量,g
酒石酸钠含量(g/kg)=酒石酸含量(g/kg)×1.293
酒石酸氢钾含量(g/kg)=酒石酸含量(g/kg)×1.254