溶液的过饱和度、过冷度及获得方法
出处:按学科分类—工业技术 中国轻工业出版社《制盐工业手册》第300页(2448字)
(一)过饱和度及其表达式
过饱和度 在一定条件下,溶质含量超过饱和的程度。它的表示式:
1.绝对过饱和度(浓度推动力)
⊿C=C-C* (2-5-1)
2.过饱和比(过饱和系数)
S=C/C* (2-5-2)
3.相对过饱和度
σ=⊿C/C*=S-1 (2-5-3)
在以上三式中:C是溶液实际浓度,C*是溶液在同一温度下的平衡(饱和)浓度(即图2-5-9AB线);只有⊿C有量纲(g/1000g水,g/1000g溶液,g/L溶液),其数值随浓度表示方式的不同而差别很大,但对S和σ的影响却不很明显。表示过饱和度时,必须注明溶液温度,因其平衡饱和浓度是随温度变化的。表2-5-3为20℃时无机盐类溶液的相对极限过饱和度。
表2-5-320℃时无机盐类溶液的相对极限过饱和度

(二)过冷度及表示式
过饱和度也可以用温度来表示。将某物质在t*℃时饱和溶液冷却至t℃,溶液进入过饱和状态,若无结晶析出,则该溶液的过饱和度为:
⊿t=t*-t(见图2-5-9) (2-5-4)
这实际上就是溶液的过冷度。
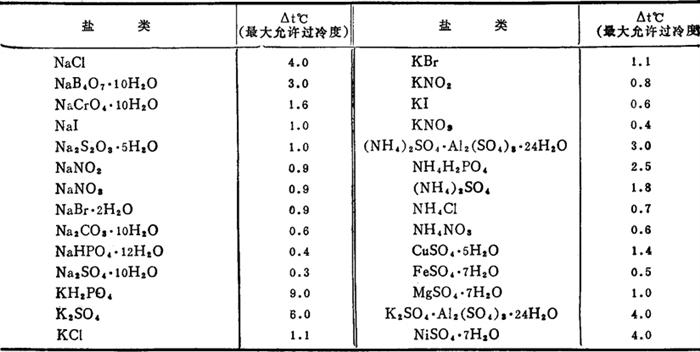
(三)一些盐类水溶液在25℃时的最大可允许过冷度(见表2-5-4)
表2-5-4 一些盐类水溶液的最大可允许过冷度
(四)亚稳区宽度
指物系的超饱和曲线与饱和曲线之间的距离。其垂直距离代表最大过饱和度⊿Cmax,其水平距离代表最大过冷度⊿tmax,两者之间的关系为:
⊿Cmax=(dc*/dt)·⊿tmax (2-5-5)
式中 c*——饱和浓度
dc*/dt——饱和曲线的斜率
测取亚稳区宽度是为了取得较为确切的△Cmax值或⊿tmax值,作为设计中选择适当过饱和度的依据;它也作为界限,以防止操作进入不稳区,降低产品质量。
(五)获得过饱和的方法
1.蒸发法 在常压、加压或减压下,采用强制加热或日晒蒸发,使溶液浓缩,达到过饱和。蒸发法结晶耗热多,合理利用热能及节能极为重要。此法主要用于溶解度随温度的降低而变化不大的物质或具有逆溶解度的物系,如图2-5-10中曲线Ⅰ、Ⅱ所代表的dc*/dt值很小或为负值的那些物系,例如海盐生产、真空制盐等。
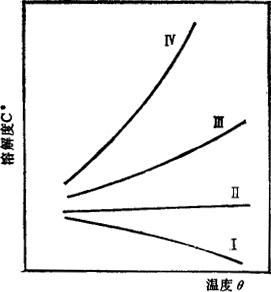
图2-5-10 溶解度曲线的分类
2.冷冻法 使溶液冷却降温,成为过饱和溶液。此法适用于溶解度随温度的降低而显着下降的物系,如图2-5-10中溶解度特性以曲线IV为代表的那些物系,它们具有较大的dc*/dt值。
冷却的方法又可分为自然冷却、间壁冷却和直接接触冷却。例如盐田冻硝(Na2SO4·10H2O)就是采用自然冷却法。
3.真空冷却法 真空冷却法是使溶剂在真空条件下闪急蒸发而绝热冷却,实际上是以冷却和浓缩两种效应来产生过饱和度。
此法适用于dc*/dt值中等的物系,如曲线Ⅲ所代表的。
以上三种方法的适用范围的划分不是绝对的,采用时应根据具体分析、计算而定。
4.盐析法 加入某些物质,使结晶物质的溶解度降低而达到过饱和。加入的物质可以是固体、液体或气体,一般叫做增浓剂或沉淀剂,能溶解于原溶液的溶剂中,但不溶解被结晶的物质,以便必要时易于将溶剂与增浓剂的混合物分离(如采用蒸馏法)。此法因常用氯化钠为沉淀剂,故称盐析法。例如:在联合制碱法中,向低温的氯化铵母液加入氯化钠,利用同离子效应,使母液中的氯化铵尽多地结晶析出,以提高收率;在氯化钾生产中,将生产光卤石后含氯化镁多的母液兑入苦卤中,使氯化钠因溶解度降低而析出;在不纯的混合水溶液中,加入适当的溶剂如甲醇、乙醇、异丙醇、丙酮,以制取纯的无机盐,等等。
5.反应结晶法 气体与液体或液体与液体之间进行化学反应,达到过饱和后,产生固体沉淀;小心控制过饱和度,也可获得符合粒度分布要求的晶体产品。例如在专用设备中用盐水与窑炉气生产碳酸氢钠等。在制盐工业中,需除去杂质离子(Ca2+,SO42-)时,可采用反应结晶法,如:
Ca2++Na2CO3→2Na++CaCO3↓
SO42-+BaCl2→2Cl-+BaSO4↓