基本原理
出处:按学科分类—农业科学 农业出版社《土壤农化分析手册》第85页(2197字)
(一)电导的基本概念 在以电导仪测定溶液电导时,电导池中溶解于水中的电解质所电离出的带有正负电荷的离子,在外加电场的作用下,由于离子的移动而导电。根据欧姆定律,温度一定时,导体的电阻R与导体的长度1成正比,与导体的截面积A成反比,可用下式表示:

式中R为电阻(单位为欧姆Ω),ρ为比例常数,称作比电阻或电阻率,其物理意义是长为1cm,截面积为1cm2的导体的电阻值,电阻率因物体性质不同而异。
电导或电导度(L)是电阻的倒数,单位为西门子(西,S),旧称“姆欧”( )。即:
)。即:

式中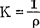 为比电导或电导率,是长1cm,截面积为1cm2导体的电导。就溶液而论,它是电极面积为1cm2,两极相距1cm时溶液的电导。单位为西门子/厘米(S/cm)。
为比电导或电导率,是长1cm,截面积为1cm2导体的电导。就溶液而论,它是电极面积为1cm2,两极相距1cm时溶液的电导。单位为西门子/厘米(S/cm)。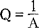 是电导池常数,也称电导电极常数。对于电解质溶液,电导率不仅决定溶液中所存在离子的多少(浓度)及其性质(离子负荷,离子迁移率等)有关,而且与溶液的温度、电导电极常数Q值也有一定的关系。
是电导池常数,也称电导电极常数。对于电解质溶液,电导率不仅决定溶液中所存在离子的多少(浓度)及其性质(离子负荷,离子迁移率等)有关,而且与溶液的温度、电导电极常数Q值也有一定的关系。
(二)溶液温度对电导的影响 离子的电导(或电导度L)随温度而变。对于大多数离子而言,每增加1℃,电导约增加2%。各种离子电导的温度系数是不同的,就是同一离子在不同的温度范围内,温度系数也不相同。例如H+温度系数为1.42%,OH为1.6%,Na+为2.09%,Ca2+为2.1%;土壤饱和浸出液在15-25℃的范围内温度系数为1.98%,而在25-35℃范围内则为2.07%。由此可见,在溶液和稀的土壤悬液的电导测定中,温度系数可按2%来计算。通常都把溶液的电导换算成25℃时的电导,若测量时温度不是25℃,可利用表2-10中的换算因数求出被测溶液在25℃时的电导率,以便于比较。
其计算公式为:

式中:Lt0——溶液在25℃时的电导;
Lt——待测液在t℃时的电导;
ft——电导的温度换算因数。
(三)电导电极常数的测定 对某电极而言,电极铂片面积(A)及两极间距离(1)不是标准的,电极铂片的有效面积和两铂片间的距离是无法直接准确测量的。因此在电导测定中,一般须先测知电导电极常数,以后计算电导率。测定电导电极常数常用的方法是测量一个已知电导率溶液的电导,根据公式 计算求得电导电极常数Q。已知电导率的溶液一般用氯化钾标准溶液,其电导率已被精确测知。现将不同浓度,不同温度氯化钾的电导率列表2-11。
计算求得电导电极常数Q。已知电导率的溶液一般用氯化钾标准溶液,其电导率已被精确测知。现将不同浓度,不同温度氯化钾的电导率列表2-11。
例如:测出0.02N氯化钾的溶液25℃电导L是4.382×10-3S,氯化钾溶液的电导率K是2.765×10-3S/cm,则电导电极常数Q值为:
表2-10 电导的温度换算因数


采用不同浓度的氯化钾溶液测得的电导电极常数往往不是相等的。为了避免由于K值的不一致而引起误差,在测量电导电极常数时最好选用一个适当浓度的氯化钾溶液,此溶液的电阻与欲测介质的电阻大致接近。或者用另一办法即测绘一条氯化钾溶液在不同浓度时的电导电极常数曲线。
表2-11 氯化钾溶液的电导率(S/cm)

(四)测量原理 电导仪是采用交流电桥与电导电极相配合来测量溶液的电导。其线路结构如图2-20所示。

图2-20 电桥平衡法测量电导的线路结构图
1.电导池 2.振荡器 3.交流放大器 4.整流 5.电表
图中R1、R2、R3、Rx构成韦斯顿电桥,其中Rx代表电导池的池电阻,振荡器产生交流电压施加至桥的AB端,从桥的CD端输出,经交流放大器放大后再整流以将交流讯号变成直流讯号推动电表。当电桥平衡时,电表指零,此时  ,R1,R2称为“比例臂”,由准确电阻构成,可选择R1/R2=0.1、1.0及10,R3是一个带刻度盘的可调电阻或精密的多位数字电阻箱(或称量程电阻)。现以国产DDS-11型电导仪为例:
,R1,R2称为“比例臂”,由准确电阻构成,可选择R1/R2=0.1、1.0及10,R3是一个带刻度盘的可调电阻或精密的多位数字电阻箱(或称量程电阻)。现以国产DDS-11型电导仪为例:
国产DDS-11型电导仪是一种直读式电导仪,仪器的工作原理如图2-21所示。

图2-21 DDS-11型电导仪测量原理图
1.振荡器 2.电导池量程电阻 3.稳压电流 4.放大器 5.讯号整流 6.表头
根据欧姆定律及图2-21可看出振荡器的输出电压E(标准电压)在电导池的等效电阻Rx与量程电阻Rm(标准电阻器)上进行分压。
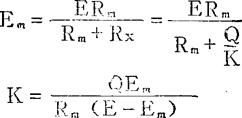
当E、Rm、及Q均为常数时,电导率K的变化必将引起Em作相应的变化。所以通过测量Em的大小,即可测出溶液电导率的高低。