花药培养培育新品种
出处:按学科分类—生物科学 农业出版社《植物细胞培养手册》第209页(8449字)
自Guha和Maheshwari(1964,1966)首次报道花药培养南洋金花小胞子直接产生单倍体胚后,许多学者从事于雄核发育单倍体诱导。采用这种简易技术能产生大量单倍体鼓励了生产和利用单倍体于基础和应用遗传学。花药培养技术有所改进,并扩展到被子植物26种60属的171种。中国学者于1970年开始这个领域的研究。首先取得水稻和小麦花粉产生的植株。继而从事于许多种的研究,如玉米、黑麦、小黑麦、烟草、棉、大豆、油菜、橡胶树、中国白菜和辣椒。中国首次诱导花粉产生植株的种列如表10-2。
表10-2 中国首次取得的花粉产生植株的种

曾提出过花药培养取得的同质双单倍体植株将能缩短培育新品种所需世代数。目前存在于单倍体应用上的问题是:(a)若干重要经济植株如棉花未能得到再生植株;(b)一些重要作物如大豆和玉米花粉植株诱导频率低;和(c)一些花粉植株具有遗传和染色体不稳定性。正在研究中。
(一)影响培养的花药反应因子
曾测验了影响诱导花粉再生植株的因子:(a)小胞子适宜发育时期;(b)培养基成分,和(c)培养条件。
1.选择适宜发育时期花药用于诱导 虽然四分体和成熟花粉能发育成花粉植株。不是在花粉任何发育时期能取得最高花粉植株。例如小麦花粉母细胞到成熟花粉在培养的花药中能诱导产生愈伤组织。当用含有单核中或后期小胞子诱导培养,愈伤组织频率最高(He和Ouyang,1980)。其它种也与小麦相似(表10-3)。
表10-3 几种禾谷类作物用于诱导的适宜花粉时期

2.培养基改进 培养基是诱导和控制花粉粒发育成完整植株的主要环境因素。
(1)增高蔗糖浓度 Ouyang等(1973)用蔗糖从0.088增加到0.18M取得了小麦花粉植株。蔗糖不仅调节培养基渗透压,也可能是最有效碳源。目前已规定小麦花药培养最适用量是0.26M,玉米0.35M。曾用较高蔗糖用量取得成功的种,如油菜、小黑麦和大麦(从0.18增到0.35M)。
(2)调节铵态氮与硝态氮比率 Clapham(1973)和Chu等(1975)发现高浓度铵离子抑制大麦和水稻花粉愈伤组织形成。据此,N6培养基减少铵离子和改变铵与硝态氮比率(表10-4)。已证实N6比其它合成培养基,对水稻和其它禾谷类花药培养更为适宜(表10-4)。
(3)马铃薯培养基 测验了马铃薯、山芋、山药、番茄、小麦芽、水稻胚乳和灌浆期玉米的自然提取物作为合成培养基的附加物。有两特征:诱导率高和制备简便。其中马铃薯水提取液最有效。首先用于烟草继之在水稻花药培养中,用以代替Miller培养基的主要组分。诱导花粉胚或花粉愈伤组织与相应合成培养基的相等。但由于马铃薯块茎主要盐类含量视品种而有不同,马铃薯培养基诱导效果不稳定。最近Chuang等(1978)作了改进,叫马铃薯Ⅱ培养基,含有10%马铃薯水提取液, WH培养基大元素和MS铁盐和硫胺素(表104)。其诱导率比合成培养基要高得很多。
WH培养基大元素和MS铁盐和硫胺素(表104)。其诱导率比合成培养基要高得很多。
表10-4 N6组分和马铃薯Ⅱ培养基组分
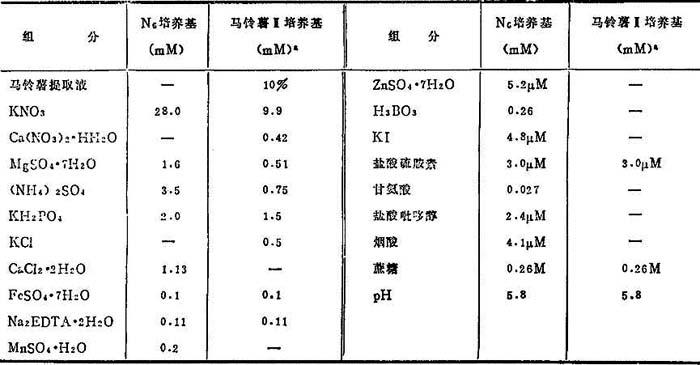
a.小麦花药培养用。
3.改进培养条件 培养的物理因子如温和光影响花粉愈伤组织的诱导效果。
(1)培养期间的温度 小麦和油菜形成愈伤组织频率,随温度增高而增加。胡含等(1982)近年发现在转入正常温度(24℃)前,用较高温度(33℃)处理小麦花药几天(8天),愈伤组织频率增高。绿色植株数增多。虽然供体植株生理条件影响着愈伤组织诱导效果。主穗花药的分化再生植株频率比分蘖穗为高。
(2)低温 培养前低温处理可能增高愈伤组织诱导频率。小麦经1-4℃预处理48h,频率增加2倍。水稻和其它禾谷类作物亦然,因此得到广泛采用。几种禾谷类作物的低温处理的适宜温度和时间综合于表10-5。
表10-5 花芽低温处理程序

(二)花粉植株特性
1.同质花粉植株稳定性 单倍体染色体加倍得到同质二倍体。早期花药培养研究,用F,杂种及其亲本品种为材料,直接查明花粉植株的遗传稳定性,如烟草和小麦。分析了小麦花粉系(H3)和亲本的三种性状(株高、穗长、种子重),H3的变异系数比亲本的较低或接近相等。这种结果与预期的H3一致性和稳定纯系品种相似相符。它们的单倍体不出现分离。
最近用未加选择的花粉品系群体取得结果,小麦、水稻、玉米和烟草约90%二倍体系遗传表现一致。计算小麦花粉品系444个,其中89.2%是一致的,10.8%出现分离。其中分离性状包括株高(19株)、穗形(10株)、芒(2株)、籽粒颜色(5株)、孕性(6株),春性或冬性(6株)。
Hu等(1978)对小麦54株(H1)根尖染色体细胞学研究,以基础染色体数(x)为准,可将花粉品系分成5类:3x为38株(70.4%),6x为10株(18.5%),5x为2株(3.7%),混倍体为3株(5.6%)和花药植株1株(1.8%)。72株H1PMC细胞研究结果:3x为44株(61.1%),6x为19株(26.4%);8x为l株(1.4%),缺体(6x-2)为2株(2.8%),混倍体为6株(8.3%)。证实了花药培养可取得高频率的单倍体和二倍体以及异倍体。
采用玉米品种Ba Tang Bai和Qun Danl05作供试材料,Cao等(1981)和Wu等(1980)用花药培养从花粉产生玉米无性系。最近3年Gu等(1980)将Ba Tang Bai产生的无性系每隔4周继代到新鲜培养基一次,据其全能性程度可分成4类:克隆l号的愈伤组织具有分化和再生能力大,易得绿色再生植株。Gu和Zhang(1981)细胞研究无性系l号的愈伤组织和其再生的35花粉植株,约有90%是单倍体(89.7%愈伤组织,87.4%植株),还有亚单倍体(7.9%愈伤组织,3.9%植株),亚二倍体(0.2%愈伤组织,1.6%植株)和二倍体(1.9%愈伤组织,7.1%植株)。用吉姆沙分带技术分析上述二类组织的核型,指出亲本和再生植株带型相同。进一步指出花药培养能用于取得遗传上一致植株。
2.F1杂种产生的花粉植株(H1)表型差异 小麦品种5675(外颖白色,顶芒,籽粒红色,棍棒状穗和矮秆)和Jili(红外颖,芒,红籽粒,纺锤形穗和高秆)朵交F1花药培养取得若干二倍体植株。可分成7种穗形,反映出F1的亲本性状的重组型。水稻取得相似结果Nipponbare×Chienchunpang的H1花粉植株穗形,有的是父本类型(短、较紧密的松散)和有些像母本(长、较松散),其余是二者的组合型:长紧密或短松散。
3.隐性性状表达 花粉植株群体的隐性性状频率较高于常规F2群体。这是由于单倍体植株只有一组染色体,显性性状不会像二倍体一样遮盖着隐性性状,由此后者频率较高。例如红粒小麦Sonora62与白粒Hongtu杂交,红粒是显性。比较F2与H2群体的粒色分离比率,发现H2群体中白粒频率比F2群体的高得很多。观察F2413株,红粒占313,白粒100株。分率比率为3.1∶1,但H2植株系比率为红0.8∶白1。前者与3∶1无显着差异(x=0.1364;p>0.05),而后者与1∶1相符(x=0.5;p>0.05)。Orefen×Xianoyan759,结果近于相等。这些试验证实单倍体育种能提高隐性性状的选择效果。
(三)花药培养应用于作物改良
1.单倍体产生新品种 单倍体与常规育种程序比较如图10-1。在某些情况下,单倍体育种可缩短品种培育年限达3-4个世代。例如水稻花育1号和2号从杂交到新品种推广只是5年。比较三种育种方法:花粉培养、集团和系谱,以花药培养需时最短,只经4个世代。这些品种具有高产(7500kg/ha),抗白叶枯病和适应性广。水稻中花8号、9号具有高产、抗稻瘟病,已大面积推广。胡道芬等用冬小麦F1杂种花药培养,育成新品系Jing dan2288,具有大穗,籽粒多,分蘖旺盛,抗条锈病和白粉病,短秆和抗倒伏特性。烟草品种Danyu1号经花药培养育成。具有高产和抗病特性。从F1花药培养到品种推广仅用了3年。

图10-1 单倍体与常规育种程序比较
2.培育玉米纯系和甘蔗无性系 1975年中国科学家取得玉米花粉植株后,Wu等(1980)选育出一个纯系Qun Hua,具有好配合力。在62杂交中,约90%表现增产。以411×Qun Hua最好,高产抗病。这个纯系的培育过程比常规方法短十个世代。应用于甘蔗品种改良,取得了含糖量高、秆高的花粉植株。其无性系已繁殖用于深入研究和潜在推广品种。
3.单倍体植株生产和常规育种相结合 从杂种水稻Shan You 2号F1花药培养产生的花粉植株选出了6个品系。其中4系表型与若干经济性状很像供体植株。以Shan You 7700,78-1,791,792名之。试图以此代替F1杂种品种,省去产生杂种种子的困难。
采用常规育种方法与多交花药培养相结合,克服了采用多交选种的困难。所以,花药培养不仅增高用多交法的选择效果,也显着地缩短了培育新品种所需时间。
4.产生花粉非整倍体和异倍体植株
(1)花粉植株的变异性 动、植物组织的细胞培养,其特点是染色体数和结构的不稳定性。再生花粉植株也如此。染色体变异加之以基因突变,在双子叶和单子叶的10科24属的约24种中,表现出倍数性水平、育性改变等等。McComb(1978)汇综了再生异倍体植株。常用于遗传研究和植物育种,由于它们没有像染色体变异所出现的不利状态。
(2)花粉异倍体植株的来源 花粉异倍体产生途径:反常减数分裂,核内有丝分裂,纺锤体融合,核融合和核内复制。这些现象可能发生于花粉发育不同时期。
(3)离体培养花粉发育早期 如果由于某种减数分裂反常,启动的单核小胞子不是单倍体,它产生的胚和花粉植株将出现反常染色体组成。
某些种如普通烟草,营养核在细胞质细胞器解体前启动分裂。由此核内有丝分裂可能产生二倍体再组核。这是产生加倍双单倍体的可能来源。
也有可能在花粉粒核分裂早期发生核融合。Zeng和Ouyang(1980)在离体培养花粉粒发育中观察到各种反常现象,如有丝分裂各不同时期的非同步性,不同核融合类型和核内有丝分裂。这样可能形成加倍染色体数的花粉粒和愈伤组织,以及非整倍体或自发加倍双单倍体。
生殖核有时在中期板上出现核内复制的染色体。正在分裂再复制的生殖核可能与分裂中营养核融合。由此产生的细胞系将是三倍体。单由核内再复制可能产生2n,4n和8n多倍体,而三倍体性至少包含一次融合。
(4)人工培养愈伤组织发育 愈伤组织发育后期可能出现不完全胞质分裂;所以可能产生各种反常有丝分裂,包括纺锤体融合和核内再复制,导致整倍体性,而多极有丝分裂,掺和滞留染色体则导致非整倍体性。
(5)离体培养反常有丝分裂来源 核内再复制能造成反常有丝分裂,这是常见的。单倍体组织在人工培养下产生染色体数和结构变异比二倍体组织的更为常见。
热冲击、X-射线和荷尔蒙能诱导完整植株形成双分染色体。体细胞组织正常分化期间也发生核内再复制核。双分染色体细胞可在培养中诱导其分裂,尤其是供给细胞分裂素和生长素时。
延长愈伤组织培养时间,常导致自发染色体加倍。例如小麦,71-1-11-1体细胞染色体加倍频率仅为7.25%;而同块愈伤组织在以后分化成再生植株的75-1-24则为23.4%。二者差异显着。
(6)小麦花粉产生非整倍体 当前,曾用花药培养取得各种非整倍体植株。这种材料可能用于遗传研究如基因制图。采用染色体工程技术,能取得外来添加系,外来置换系和易位系。杂种小麦外来添加系是已知野生亲本种一对染色体加进栽培小麦的完整染色体组成中。外来置换系是一对外来染色体置换栽培小麦的一对同质染色体。一个外来染色的一个臂置换同质小麦染色体的一个臂(易位系),在减数分裂中二条单价染色体同时错分裂结果。细胞内很少发生错分裂;所以常用带有主要配对抑制者ph的5B单体,通过遗传诱发在具有一个或更多外来染色体的杂种中的同质配对,从它的有血缘关系的基因转移到小麦染色体中。
采用染色体工程方法,可能把一些有价值外来基因转移给普通小麦。由此可能得到具有高产和抗病品种。采用吉姆萨分带技术,曾有可能指出Avrora和Kavkaz品种具有一对小麦一黑麦易位染色体,它至少含有1R染色体的短臂。
最近,中科院遗传所取得了各种非整倍体植株和种子,如缺体、单体、三体、四体和具双着丝点四体。这是用异品种杂种和异属杂种花药培养取得的,例如六倍小黑麦与普通小麦杂交。也曾观察到染色体结构改变,因此,可望用花药培养直接取得外来置换和易位系。
从上可知,中国学者的研究,成功地取得了几种作物种的单倍体和加倍单倍体植株。包括玉米、黑麦、小黑麦、烟草、大豆、橡胶树、辣椒和茄。最近工作已转向采用花药培养培育新品种。采用加倍单倍体培育成水稻、烟草、和冬小麦新品种和玉米和甘蔗新系。当花药培养与常规育种相结合表现着成为突出有力手段。讨论了花药培养在培育新变异系和从F1杂种系产生新奇重组体。
【参考文献】:
〔1〕Aitken-Christie,J.and J.A.Gleed.1984 Uses for micropropagation of juvenile Radiata pine in New Zealand.In:Proc.Intcrn.Symp.of Recent Advances in Forest Biotechnol.(J.Hanover,D.Karnosky and D.Keathley,eds.)Michigan Biotechn.Institute,Traverse City,Michigan,June 10-13,1984,pp.47-57.
〔2〕Bonga,J.M.and D.J.Durzan eds.1982 Tissue Culture in Forestry,Martinus,Nijhoff,Dr.Junk,Amsterdam.The Netherlands,420pp.
〔3〕Brink,R.A.1962 Phase change in higher plants and somatic cell heredity.Q.Rev.Biol.37∶1-22.
〔4〕Durzan,D.J.1984 Potential for genetic manipulation of forest tree:totipotency,somaclonal aberration and trueness to type.In:proc.Intenn.Symp.Recent Advances in Forestry Techn.(J.Hanover,D.Karnusky,and D.Keathley,eds.) Michigan Bioechnology Institute,Traverse City,Michigan,June 10-13,1984,pp.117-139.
〔5〕Durzan,D.J.1984 Explant source:Juvenile and adult phases.In:Application of Plant Tissue Culture Methods for Crop Improvement.(D.V.Evans,W.R.Sharp,P.V.Ammirato,and Y.Yamada,eds.)Macmillian Publishing,New Jersey.
〔6〕Durzan,D.J.1980 Progress and promise in forest genetics In:Proc.Symp.on Paper Science and Technology-The Cutting Edge,50th Anniversary,The Institute of Paper Chemistry,Appleton,Wisconsin,pp.31-60.
〔7〕Hardy,R.W.1983 The Outlook for agricultural research and technology.In:Agriculture in the Twenty-First Century,J.W.Rosenblem ed.Wiley,Interscience,New York,pp.97-103.
〔8〕Tomes,D.T.1984 An assessment of the impact of biotechnology on plant breeding.In:Intern.Assoc.Plant Tissue Culture Newsletters No.42,pp.2-9.
〔9〕Durzan,D.J.1984 Special Problems:Adult vs.juvenile explants.Handbook of Plant Cell Culture,Vol.2.(W.R.Sharp,D.A.Evans,P.V.Ammirato and Y.Yamada,eds.)pp.471-504.Macmillian,New York.
〔10〕Wilkins,C.P.,J.L.Cabreba,P.and J.H.Dodds 1985 Tissue cult ure propagation of trees.Outlook on Agriculture vol.14 pP.2-13.