抗线虫番茄品种育种
出处:按学科分类—生物科学 农业出版社《植物细胞培养手册》第270页(10842字)
根癌线虫(Meloidogyne spp.)是重要的植物寄生物,已知37个种中,其中7个种是侵染番茄的。以M.incognita,M.javanica,M.arenaria和M.hapla最重要。
严重感染的植物,营养根发育通常受到损伤,激素分布、矿物质转移及光合作用都发生改变,结果使顶端生长变慢,产量降低,高温时,植物枯萎,即使土中有充分水分。
线虫感染引起的经济损失很难估价。据报道夏威夷和墨西哥产量降低75%。在意大利南部、马尔泰和北加罗林那损失估计为50-85%。
此外,线虫感染还使根变得易受其它病原感染,甚至完全丧失抗性。
化学控制是可行的,但花费太贵而且只是意味着减少土壤中接种物的临时解决办法。这样看来,遗传抗性的培育是一个很明智的抗植物寄生线虫的途径,这不仅是经济观点,而且可以避免生态的影响。已知有抗线虫能力的番茄有65种以上的栽培品种,而且无疑还有许多未知的。
(一)线虫抗性的筛选
检查线虫抗性的传统方法,是把幼苗培养在严重感染的土壤中直接观察根瘿的发生。
根据症状的严重程度分级,高度抗性植物通常没有虫瘿,只是偶尔有些小虫瘿,抗性差的植物常出现较多虫瘿。
为了提高筛选效率,对线虫筛选方法作了一些修改。Rick和Fokes(1974)提出了很重要改进。以淀粉凝胶电泳研究线虫的同工酶,发现VFN8和其它5种抗线虫栽培品种一样,在决定酸性磷酸脂酶的座位1上有一个突变,这一等位基因,Aps-1+以前是知道在L.peruvianum中出现,番茄的所有其它栽培品种具有等位基因Aps-1+。以Aps-1-与敏感的Aps-1+杂交,其子代分离为16+/+∶19+/1:101/1。对Aps-1来说,只有在基因型为+/+时,对线虫敏感,Mi与Aps-1之间的关系认为是一个紧密的连锁,或单一基因的多效性。
Meclina-Filho和Stevers(1980)研究来自世界各地的许多栽培品种和培育品系。根据酸性磷酸酯酶的座位1(Aps-1)的基因型,区分园艺学特性和抗性。敏感品系总是纯合的Aps-l+。抗性的自然授粉栽培品系为Aps-l+/+或Aps-11/1,而杂种栽培品种为Aps-1++或Asp-11/1(图12-5)。在所有的情况下,都可以核对抗性的自然授粉品系Aps-1+/+的谱系,起源于番茄×L.peruvianum的一个单个的F1代可能在早期几代,在线虫抗性整合到番茄的过程中,发生了Aps-11和Mi基因的杂交。这就解释了,为什么Aps-1+/+抗性栽培品种,如Anahu,VFN8和它的衍生品系,保持了在L.peruvianum中出现的Aps-l1与Mi联合(图12-6)。
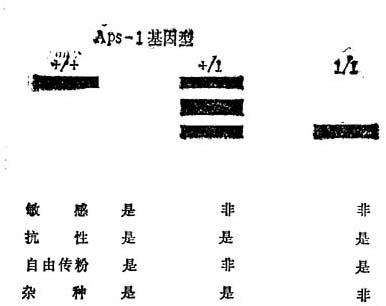
图12-5 番茄品种间Aps-1基因型的带型

图12-6 番茄抗线虫品种的培育
(二)检测Aps-1的方法
Mi与电泳突变体Aps-l1的偶尔联合为番茄线虫抗性的培育提供了新的方法。而这实际上已经被植物育种机构成功地进行应用。
1.电泳装置 Tanksley(1979)设计的装置是利用淀粉凝胶检测同工酶的非常好的系统。为了增加每块胶上的单个标品数量,对原来装置进行了小改动,将胶板宽面部分与缓冲液槽平行。缓冲液槽的尺寸不变,这样可以增加装置的用途,在需要长时间电泳以获得好的分解力时,可以按通常的方式使用。改进后的电泳以T形的电极绵代替原先距形的电极绵,将宽的部分接触胶,这样一来,35根3.2×5.0mm的电极可以插入一块胶板中,而不显得拥挤。可以用更窄的电极进一步增加样本数目,这样情况下带子变窄但乃很清楚,用这种更窄的电极可以在一块胶板上同时检测40种样本(植物)。
2.胶板与电极缓冲液的pH 以一系列胶板与缓冲液的pH的不同组合进行试验,范围以7.0-9.0,间隔为0.4。电极缓冲液为0.3M硼酸盐溶液,以4N NaOH调到所希望的pH。胶板pH可以增加三羟甲基氨基甲烷(Tris)或柠檬酸盐的浓度来进行调整。开始时用25ml0.0152M Tris和25ml0.036M柠檬酸用蒸馏水定容至1000ml的标准溶液,这一办法也改变了缓冲物质的离子强度。
在各种硼酸盐溶液(电极缓冲液),在供试pH值下,谱带的分布及相对于前沿的迁移都没有不同,但是,对通过电流的阻力有明显效果。当缓冲液槽的pH为7.4时,电压要360V才能使电流值达到40mA。在pH7.8,8.2和8.5时,这一数值大约分别为220、210,和190V。在pH较低时,要想通过升高电压加快电泳速度是不能成功的。因为这不可能升高电流值,另外,电压高时,释放的热量大多使胶板质量变差。pH高达8.6时,电压为270-285,电流值可达65mA。在这些条件下,没有多余热量释放,带的分辨力非常好,电泳时间从低pH硼酸盐溶液时的4-5小时降到1.5-2.0小时。
相对迁移,Rf=(带迁移mm/硼酸盐前沿迁移,mm)×100,以及Aps谱带的分辨力强烈地受到胶缓冲液浓度的影响,浓度可通过改变Tris量来改变,结果可见到胶缓冲液pH值的一系列变化。pH7.0时,Aps-1的带与前沿一道迁移(Rf=100)。这一座位无法分辨。而Aps-2座位带Rf值较低,能很好地分辨。在Aps-2带下是酸性磷酸酯酶,在pH7.0的这些胶板中活力很高,但只看到一个长的模糊不清的带,随着pH上升,带的Rf值下降,比如,pH8.6时,Aps-1+的Rf值为87。此外,在高pH(8.6)时,座位1和2,还有两个低Rf值带的分辨力都很好,除上述四条带外,偶尔还会看到染色很浅的第五条带,离起始点更近,Rf为15。由于座位1与Mi连锁,讨论只涉及座位1,然而在对番茄属种进行其它研究时。其它带的分辨力可能是很有用的。pH9.0时胶板模式与pH8.6时一样,只是所有带的活力都有一点降低。
3.淀粉浓度 马铃薯Sigma淀粉水解后,专门用于电泳,淀粉浓度从10%到14%,每隔0.5%取样试验,在两种胶的淀粉浓度相差小于0.5%时,没有什么明显区别。
在各种不同淀粉浓度液中,未看到对带的明晰程度有影响。但是,相对于前沿带的迁移(Rf)是不同的,随着淀粉浓度下降,带Rf值上升。比如,淀粉浓度为14、13、12、11和10%时,Aps-1+的Rf值分别为79.1,80.0,86.5,100和100。从Rf值看来,当淀粉浓度低于12%时,由于带与前沿一道迁移,Aps-1不能分辨。
4.染色液 在胶板中有一个16cm的纸芯吸入Aps-1杂合的植株叶的抽提液,以不同的底物、染料和缓冲液pH来检测对Aps-1的效果。在走完以后,按实验要求,象许多垂直电泳那样,切去最后2mm小片。每一个都分别在包含有不同检测溶液的萌发箱中染色。
所用底物如下:α-酸性磷酸萘酯、β-酸性磷酸萘酯、AS-MX磷酸萘醇、AS-BI磷酸萘醇。对每一底物用三种不同染料测试:坚牢黑钾盐(Fast Black K Salt),四氮化的邻联(DiazoBlue),和坚牢紫酱。用0.5M醋酸缓冲液配制成液,pH5.65时,所有底物和染料浓溶度均用1mg/ml。为了取得上述最好组合,染色液的pH影响先在3.0到7.5范围内每隔0.5进行比较,更进一步在5.0-6.0之间每隔0.1进行比较,以取得最适组合。
番茄叶几种酸性磷酸酯酶同工酶看来随供试不同的底物和染料而反应不同。比如,座位1的酶带,在与α-和β-酸性磷酸萘酯反应时,可以在液中看到,而与Srgma AS-MX反应时,则看不到。底物β-酸性硫酸萘酯对检测Aps-1是最好的。坚牢黑钾盐和邻联(二)茴香胺也是令人满意的。而后一染料结果稍好。然而,应当避免使用邻联(二)茴香胺,因为它是公认的致癌物质。
利用β-酸性磷酸萘酯和坚牢黑钾盐,在pH3.5到7.5时,在胶板中染色可以检测到酸性磷酸酯酶活性。pH4.0或更高时,可以分辨Aps-1。但随着pH上升,胶板底色加深。在pH为6.0或更高时使基因型检测变得困难。而且在pH6.0或更高时,带显色所需时间显着增加。染色液pH值最好是5.5。
5.薄片位置 标准的6mm厚的胶板可以水平地分成几层,以不同厚度的玻璃捧为薄片引导,可以得到4个1mm厚和1个2mm厚的薄层。先应进行观察凝胶上酶带的分辨力试验,而后才在普通凝胶板进行观察基因型子代的试验。
对不同薄层进行检测,酶带的分辨质量是不同的。最低部薄层(2mm厚)中酶带最窄,越到顶部酶带越宽。带染色时成V形,其顶端向着玻璃模型。不但水平的而且垂直的胶板中,也都能看到在下层的凝胶染色带明晰程度增强。
6.电泳所需的时间和电流 酶迁移速率,由此而定的走样时间,与所用胶板电流成比例,胶板电流逐步升高以缩短试验走样时间的可能性,胶板要走到硼酸盐前沿离起始点7-8cm时为止。当工作电流确定以后,对胶板进行连续试验,让硼酸盐前沿的终止离起始点越来越近。
象前面所解析的那样,当硼酸盐的pH增高(8.6)时,胶板电流上升,迁移加快,粗提取液进入胶板的速度在40mA下很快,只要15min,而在低pH下为40分钟,在纸芯除去后,原电流可调到高达65mA,电压保持在270和285之间。
当前沿到达8cm处时,带的分离好,关闭电源,然而在前沿移动只有5.5cm时,可能带的分辨力好,清晰地显出Aps-1。采用上述操作过程进行可不超过2h。降低走样时间是很方便,这样可以使一个人在8h内比较四块胶板、调制140个样本,进行电泳和记录结果。
7.发育时期与植物组织 从干种子到成熟植物的各个时期,尽可能做各种组织的Aps-1检测,以确定合适的发育时期和组织类型。
(1)干种子到2个星期的幼苗 用发芽箱,把种子放在湿的吸水纸上发芽,温度24℃,荧光灯光照12h(约70μEm-2sec-2)。取适当的植物组织,加入约20μl。提取缓冲液,用塑料棒压碎,得到粗提液,用于电泳。用干种子,带有5-10mm长胚根的发芽种子及单独用胚根制成匀浆,取子叶完全伸长的幼苗,分别以根、基部茎、子叶及带有茎尖分生组织的子叶为样本,进行检测。
干种子和发芽种子以及其对应的基部茎和子叶都没有显示出Aps-1活力。带有顶端分生组织的子叶样本表现出很好的活力,并且象混合样品中表明的那样,可以用于播种前筛选。
(2)3-13个星期的植株 为能在同一时间评价不同年龄连续系列,每隔10天进行一次播种,连续进行10个星期。在温室中将标准花盆土与沙土以1∶1混合,装入金属扁盘中,供植株发芽和生长,放进温室,日间26.5℃,晚上22℃。
检测的植物不仅包括Aps-1的基因型+/+、 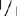 ,和+/
,和+/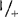 ,还包括明确的(sp)和不明确的(sp+)生境型,如:77B175-1(sp;
,还包括明确的(sp)和不明确的(sp+)生境型,如:77B175-1(sp;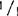 ),UCX97-3(sp;+/+),矮红樱桃树(sp;
),UCX97-3(sp;+/+),矮红樱桃树(sp;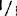 ),IAC3946(sp+;+/+),和F1SRC×LA1178(sp+;
),IAC3946(sp+;+/+),和F1SRC×LA1178(sp+; )。每一个栽培品种,分别检测三株植物每个时期的小叶。取三周龄植株(第一对真叶形成),除了做小叶外,还测验顶端分生组织、子叶和根。
)。每一个栽培品种,分别检测三株植物每个时期的小叶。取三周龄植株(第一对真叶形成),除了做小叶外,还测验顶端分生组织、子叶和根。
根据3-13周龄植株小叶试验结果,所有基因型酶带分布和深浅都没有什么多大不同。周龄植株,根基部茎和顶端分生组织都有Aps-1的活性,这个时期的子叶显示活性很低,有些植株根本看不到Aps-1带。
(3)成熟植株 大田基因型+/+,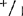 ,和
,和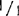 的叶也可用于电泳:在生长季节一直到收获时节,大约每隔30天取样一次。在生长季节中,电泳同样可用于苗组织,叶柄,花序梗,花蕾、花瓣,未成熟和成熟花药,花粉粒,未成熟果实(2.0cm直径),落果期果实,和成熟果实。测试花粉采用Tanksley等(1981)技术。将五个离体花药的花粉与细沙和1%的谷光甘肽在0.1M Tris缓冲液(pH7.5)混合,用玻璃棒在塑料小试管中磨碎。
的叶也可用于电泳:在生长季节一直到收获时节,大约每隔30天取样一次。在生长季节中,电泳同样可用于苗组织,叶柄,花序梗,花蕾、花瓣,未成熟和成熟花药,花粉粒,未成熟果实(2.0cm直径),落果期果实,和成熟果实。测试花粉采用Tanksley等(1981)技术。将五个离体花药的花粉与细沙和1%的谷光甘肽在0.1M Tris缓冲液(pH7.5)混合,用玻璃棒在塑料小试管中磨碎。
可用叶在整个生长季节中检测大田生长的植株,与温室生长的幼苗相比,酶带的分辨稍差,但是还是能作正确筛选的。两个连续季节观察中,偶尔可以观察到+带丨比带及杂二聚体带要淡得多,在绝大多数情况下,杂交植株只有丨带和杂二聚体带,+带差不多是察觉不到的。
尽管有这个问题,也不应否认这样条件下的植物分类。因为纯合的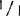 植物总能产生一个迁移滞后的深色带,而杂合体总是产生两个区别明显的酶带,与纯合的+/+基因型产生的难以分辨的或很淡的+带形成对照。根据成年植株的其它组织来看,在苗、花序梗、萼片和未成熟果实和花药中Aps-1的活力很低。实际上,在叶柄,花瓣、成熟花药,落果期果实和成熟果实中什么都观察不到。从成熟花药取得的花粉可以看到很强的活性。杂合植株花粉只有等位基因+和丨的酶带,而缺少孢子体植物中通常所见的杂二聚体带。
植物总能产生一个迁移滞后的深色带,而杂合体总是产生两个区别明显的酶带,与纯合的+/+基因型产生的难以分辨的或很淡的+带形成对照。根据成年植株的其它组织来看,在苗、花序梗、萼片和未成熟果实和花药中Aps-1的活力很低。实际上,在叶柄,花瓣、成熟花药,落果期果实和成熟果实中什么都观察不到。从成熟花药取得的花粉可以看到很强的活性。杂合植株花粉只有等位基因+和丨的酶带,而缺少孢子体植物中通常所见的杂二聚体带。
杂合植株花粉缺少中间的杂二聚体带,这表明座位Aps-1在减数分裂后期表达。因此这一座位不仅在孢子体中起作用,似乎在配子体时期也能转录和翻译。这并不令人惊讶,最近研究已经揭示,番茄孢子体与配子体的基因表达具有广泛的重叠。
8.样本保存 取新鲜叶的提取液(预先抽提后,保存在冰冻条件下的)以及完整叶抽提液(保存在冰冻条件下的)和分析前才磨碎的提取液分别电泳进行比较。磨碎样本的冰冻保存期从一天到一年,完整叶的冰冻保存期达9个月。冰冻样本保存在紧紧包扎的微试管中,贮放于-20℃中。
在试验的冰冻保存期内,Aps-1活力很稳定。贮存9个月的磨碎液样本还能观察到适当活力。与新鲜材料相比,酶带变得稍为模糊。即使只保存过夜,也会有这一现象,而且保存的磨碎液样本和保存的完整叶都有这种现象。虽然后者较不明显。用冰冻保存样本,可以得到植株明确的基因型。因此,我们宁愿保存完整叶而不是保存提取液。
9.抽提 从3-4周幼苗取一片小叶(约1.5×7.5mm),放在塑料碾板上,加2-3滴抽提液,用塑料棒把样本彻底碾碎,用滤纸芯吸收得到的液汁,放在纸芯架上。在插入凝胶前,低温保存。测验了各种浓度的下列试剂作为抽提液。聚乙二醇(MW,6000)、聚吡咯烷酮乙烯酯PVP(MW,36000)、Dowex-50、Amberlite、谷胱甘肽、β-羟基乙醇、吐温-20和Triton X-100,0.1M,pH7.5的Tris缓冲液等用作溶剂。用纯的抽提液和单独使用缓冲液得到的抽提液为对照。
不加抽提物质的叶抽提物产生的结果可令人满意。在所试的一些化合物溶液中,浓度分别为2%和5%的Triton X-100与PVP混合溶液得到的结果较好,以0.1M、pH7.5的Tris缓冲液为溶剂,与对照相比,当用上述抽提液时,酶带变窄而活力降低,这样Aps-1及其它座位的分辨力增加。在幼苗叶中,座位Aps-3的结果最明显。虽然抽提液还是必须加入的,可使磨碎过程方便得多,又可用于很小的样本,如3周龄幼苗单个小叶。一旦制备成抽提液,可贮放在冰箱中几个月。
10.混合样本 由于如下所述理由,采用单个纸芯吸取各种不同基因型植物的抽提混合液进行分析,用软木钻孔器从基因型+/+和 的植株中取得8mm直径的小叶。分别以1∶1和1∶10的+/+和+/-两种叶片放在一起碾碎制得混合抽提液。以单基因型样本为对照,另外测验扩大到包含基因型
的植株中取得8mm直径的小叶。分别以1∶1和1∶10的+/+和+/-两种叶片放在一起碾碎制得混合抽提液。以单基因型样本为对照,另外测验扩大到包含基因型 的诸基因型混合液。
的诸基因型混合液。
以基因型+/+和 的混合样本进行试验,即使采用7份+/+与1份
的混合样本进行试验,即使采用7份+/+与1份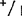 比例,酶谱中除有酶带+外,还有等位基因1和杂二聚体的酶带。在这样高度稀释的条件下,等位基因1酶带和杂二聚体的带实际上是看不到的,但是把凝胶与背景完全干净的只含+/+基因型的凝胶相比,则发现有很淡的痕迹。如同一基因型按2∶1的比例混合成样本,与对照样本的区别很明显。基因型+/+与
比例,酶谱中除有酶带+外,还有等位基因1和杂二聚体的酶带。在这样高度稀释的条件下,等位基因1酶带和杂二聚体的带实际上是看不到的,但是把凝胶与背景完全干净的只含+/+基因型的凝胶相比,则发现有很淡的痕迹。如同一基因型按2∶1的比例混合成样本,与对照样本的区别很明显。基因型+/+与 混合同样如此。这种情况下,在凝胶中可看到两条带(+/+和
混合同样如此。这种情况下,在凝胶中可看到两条带(+/+和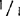 )。
)。
假如通过系谱筛选或单粒种子传代培育线虫抗性,最好的途径是对F2代各个植株进行分类,只让同质 品系发展下去。但分类也可延迟到F3代或更高世代进行。在这些情况下,采用混合样本试验可能是很有用程序。为了从分离品系中,区分出同质植株,一般都是测试6棵植株。每三株植物混在一起分成2个混合样本进行试验。如果两个样本都只选择与Aps-1
品系发展下去。但分类也可延迟到F3代或更高世代进行。在这些情况下,采用混合样本试验可能是很有用程序。为了从分离品系中,区分出同质植株,一般都是测试6棵植株。每三株植物混在一起分成2个混合样本进行试验。如果两个样本都只选择与Aps-1 相应的带,那么,这种群体内异质或同质+/+植株,将不包括在异质植株后代的6株植物中的概率为(1/4)6或0.0002。
相应的带,那么,这种群体内异质或同质+/+植株,将不包括在异质植株后代的6株植物中的概率为(1/4)6或0.0002。
这6株植物能可靠地利用。因为根据下面两组数据表明,位点Aps-1是单基因方式分离的:
(1)回交群体分离为1∶1。这些群体由881株植物组成,包括6个不同遗传背景的杂种(表12-4)。
表12-4 Aps-1的回交分离

a.分离的统计分析:总计自由度=6; x2=5.76ns;混合液自由度= 1,x2=1.39ns;异质性自由度=5,x2=4.75ns;未调整x2,以1∶1比率为准计算。
表列杂交,包含正反交。
(2)BC2植株的自交子代分离比为1∶2∶1。表12-5数据表明,在一个系中明显地背离1∶2∶1比率,因为同质 个体的数据有所欠缺。
个体的数据有所欠缺。
表12-5 Aps-1以Bc2自交后代的分离为准的未调整的X2

*分离的统计分析:总计自由度8,x2=14.734ns;
混合液自由度2,x2=10.345* *;
异质性自由度6,x2=4.389ns;
子代80S A1和A3与UCX97-3回交,而80S A5和A6与UCX99m-1-2-3回交已列入表12-5中。
规定采用四块凝胶板装置,一天内可筛选140个样本(70个家系)。这些可用发芽箱中生长了两周的植株,在冬季和早春季节进行筛选,最为合适,费力最小。在此初步筛选基础上,只有同质 的品系用于播种,然后进行大田观察判断。
的品系用于播种,然后进行大田观察判断。
(1)酸性磷酸酯酶的检测方案
母液 化学物质 最终体积 保存
(A) 电极缓冲液 硼酸334g 181蒸馏水 室温下可放置几个月
(B) 凝胶缓冲液 Tris 92g 500ml蒸馏水 冷藏可保存几个月
(C) 凝胶缓冲液 柠檬酸水7.35g 500ml蒸馏水
500ml蒸馏水, 同B
(D) 染色缓冲液 醋酸钠90g 用浓硫酸把pH调到5.5 同B
(E) 底物 p-酸性磷酸酯1.0g萘 50ml丙酮; 50ml蒸馏水 把底物加入溶液。同B,对光敏感 Triton X-100
(F) 样本抽提溶液6.0ml;聚乙稀吡咯烷酮 300ml 0.1MTris溶液pH7.5 同B 11甘油 10ml
(G) 固定液Thimerosal(Merthiolate) 加11蒸馏水 可过滤并能无限多次重复使用,同A
(2)电流加样,40mA电流走15min。取出纸芯,电流调至65mA。直到硼酸盐前沿离开起始近6.5cm时停止(约2h)。
(3)染色液0.2黑钾盐,175ml蒸馏水,20ml溶液D,再加5ml溶液E,摇动几秒钟,立即放入凝胶,在黑暗中放2-4h。当酶带显出后,倒掉溶液,用水选两遍,加固定溶液(G)。
凝胶缓冲液:50ml溶液B,50ml溶液C,900ml蒸馏水,pH应为8.0±0.1。
淀粉:120g电泳用水解淀粉(12%)。
电极缓冲液:1800ml溶液A,用4N NaOH调pH到8.6。每槽加200ml,其余200ml淋洗海绵后放入槽内。
11.一些有用的提示
(1)在每一样品磨碎之后,把已吸收抽提液的纸芯放在合适的支持物上。当一块凝胶板的样本制成后,冷藏下保存,直至样本插入凝胶板。
(2)为防止样本间的污染,不能让纸芯吸足抽提液,把纸芯放在玻璃模型上方1mm处。
(3)凝胶板可在走样前夕制备,放置在室温下,在加样前,先把凝胶板放入冰箱中降温20min,在切刈起点,加样和去纸芯的操作过程中把凝胶板保持在低温下,方法是在冰箱外进行,把凝胶板放在凉的垫子上,垫子是以湿报纸包在塑料袋中做成的。
(4)电极缓冲液的pH可以调整,可以在走样前装入槽中,在傍晚放进冰箱。
(5)开始走样前,电源至少预热20min。当取出凝胶板时,以除去纸芯,把电源调节在稳定的位置上。
【参考文献】:
〔1〕Grisebach,H.and Ebel,J.1978 Phytoalexins,Chemieal defense substances of higher plants.Angew.Chem.Int.Ed.Eng.17:635-645
〔2〕Ingram,D.S.1977 Applications in plant pathology.In: Plant Tissue and Cell Culture(H.E.Street,ed.)pp'.463-500.Univ.California Press,Berkeley.
〔3〕Ingram,D.S.and Helgeson,J.P.(eds.)1980 Tissue culture Methods for Plant Pathologists.Black Well Seientific,Oxford.
〔4〕Medina-Filho,H.P.and Stevens M.A.1980 Tomato breeding for nematoderesistance:Survey of resistant varieties for horticultural characteristics and genotype of acid phosphatase.Acta Hortic.100:383-393.
〔5〕Alves de Lima,M.M.1980 Germination,appressorium formation and aseptic culture of Hemileia vastatrix on Coffea arabica.M.S.Thesis Ohio State Univ.,Columbus.