氯化镁
出处:按学科分类—工业技术 中国轻工业出版社《制盐工业手册》第19页(6122字)
氯化镁按无水物重量计算,是由74.54%的氯和25.48%的镁组成的。但按MgCl2-H2O体系相图(见图1-1-4)分析,除无水物外,还有含1、2、4、6、8、和12个结晶水的水合物。经试验证实,氯化镁水合物,在空气中脱水时,大约仅能脱出4个分子的水,不致发生严重的副反应;若再脱除剩余的2个分子的水,氯化镁就显着水解,生成羟基氯化镁、氧化镁和氯化氢等。在不同阶段的温度下,其反应为:
1.96~117℃:
MgCl2·6H2O MgCl2·4H2O+2H2O
MgCl2·4H2O+2H2O
2.135~180℃:
MgCl2·4H2O→MgCl2·2H2O+2H2O
3.185~230℃:
MgCl2·2H2O→MgCl2·H2O+H2O
MgCl2·2H2O→MgOHCl+HCl+H2O
4.230℃以上:
MgCl2·H2O→MgCl2+H2O
MgCl2·H2O→MgOHCl+HCl
5.304~554℃:
MgCl2+H2O MgOHCl+HCl
MgOHCl+HCl
6.527℃以上:
MgOHCl MgO+HCl
MgO+HCl

图1-1-4 MgCl2-H2O体系相图
E-低共熔点 T1~T6-水合物转化点
由以上反应可见,氯化镁水合物在空气中脱水时,不可能成为无水氯化镁。现在采用的脱水方法为:(1)氯化氢脱水法;(2)生成复盐脱水法;(3)生成络合物脱水法。现将6水氯化镁,2水氯镁和无水氧化镁的理化性质和用途,分述如下:
一、6水氯化镁
(一)物理性质
纯品为无色单斜结晶,工业品往往呈黄褐色,含氯化镁约40~50%,还含有硫酸镁、氯化物等杂质,有苦涩味。易溶于水和乙醇,在湿度较大时,容易潮解。其他物理数据为:
密度 (20℃)、1.56g/cm3; 晶格常数 a 0.9871nm,b 0.7113nm,c 0.6079nm;
折射指数 1.495,1.507; 角级 β 93.74,Zb2
熔点 116~118℃分解; 硬度 1~2
沸点 分解 反射指数 1.507
生成热298 MgCl2·6H2O-2499.06kJ/mol;
MgCl2·4H2O-1899kJ/mol;
生成自由能298 MgCl2·6H2O-2114.97kJ/mol;
MgCl2·4H2O-1623.52kJ/mol;
熵 S°298 MgCl2·6H2O 366.1J/mol·K
MgCl2·4H2O 264.01J/mol·K;
热容 Cp°298 MgCl2·6H2O 315.06J/mol·K;
MgCl2·4H2O 241.42J/mol·K。
溶解热 1mol MgCl·6H2O溶于18℃无限水中-14.23kJ/mol
1mol MgCl2·4H2O溶于18℃无限水中-43.93kJ/mol
(二)化学性质
与氧化镁和水混合则成镁水泥,MgCl2·6H2O+3MgO+4H2O→3MgO·MgCl2·10H2O。
与碱金属或碱土金属的氢氧化物起反应,则生成氢氧化镁沉淀;再加强热则生成重质氧化镁,MgCl·6H2O+Ca(OH)2→Mg(OH)2+CaCl2+6H2O,Mg(OH)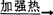 MgO(重质)+H2O。
MgO(重质)+H2O。
通CO2于MgCl2水溶液中,则生成碳酸氢镁而溶解;再加热80~90℃,则生成碱式碳酸镁。或与纯碱或碳氨起反应,也生成碱式碳酸镁。这两种碳酸镁再加热,则转化为轻质氧化镁。
与硅酸钠起反应,则生成硅酸镁沉淀;与磷酸或磷酸钠起反应、则生成磷酸镁沉淀。
(三)用途
在冶金工业中,用作耐火材料和砌炉壁的粘合剂,是生产二号熔剂和冶炼金属镁的原料。在化学工业中是生产各种镁盐的原料。在食品工业中是蛋白质凝固剂,生产豆制品。在建筑工业中,是生产镁水泥原料,在冬季施工时用作防冻剂。在农业中,可用以生产棉花脱叶剂。此外,还可用作煤矿防火剂、公路防尘剂、稳定土壤。
二、2水氯化镁
2水氯化镁的化学性质,基本上类似6水氯化镁。现仅将其物理性质列下:
(一)物理性质
白色固体颗粒,味苦,含氯化镁70%左右,还有氯化钠等少量杂质。易溶于水极不稳定,在常温下吸收空气中的水分,转成6水氯化镁,极易潮解,须用衬塑料袋的麻袋包装。其他物理数据如下:
生成热298 热容298Cp°
MgCl2·2H2O -1279.72kJ/mol MgCl2·2H2O 159.2J/(mol·K)
MgCl2·H2O -966.63kJ/mol MgCl2·H2O 115.27J/(mol·K)
生成自由基能298 熵298
MgCl2·2H2O -1118.13kJ/mol MgCl2·2H2O 179.98J/(mol·K)
MgCl2·H2O -861.82kJ/mol MgCl2·H2O 137.24J/(mol·K)
结晶松密度ρ 0.45~0.50g/cm3 溶解热MgCl2·2H2O -87.03kJ/mol。
(二)用途
2水氯化镁是6水氯化镁脱水的中间产品,可继续脱到无水物作制造金属镁的原料。浸入木材具有耐火能力,建筑上用作耐火地板,纺织工业上作加工防火纺织品用等。
三、无水氯化镁
无水氯化镁是由6水氯化镁逐步脱水,最后达到可用作生产金属镁的无水物。在脱水过程中,为防止水解发生,必须加入其他成分,不是纯氯化镁。但这些其他成分,在电解时是不可缺少的,因为可以降低电解液熔点,提高电导率,是降低金属镁生产成本所必要的。
(一)物理性质
一般的物理性质,与上述的6水物,2水物相似,仅将其他不同的性质列下:
潮解性 太强,高于6、2水合物; 熔点 714℃
色泽 白色,有光泽; 沸点 1412℃
晶形 六方形晶体; 溶解性 溶于水和乙醇
密度(25℃) 2.316~2.33g/cm3; 熔融热 33890.4J/mol
折射指数 1.675,1.59;
蒸气压

晶格常数 a=0.622nm α 33°36′;
溶解热 ΔH溶解 18℃ 400mol H2O 85.35J/mol;
生成热298 ΔH生成 -641072±460J/mol;
生成自由能298 -601.53kJ/mol;
气化热 136.77kJ/mol;
热容 273~991% 72.40J/(mol·K);
磁化率×10-6 普通温度 -47.4c.g.s制电磁单位;
结晶潜热 -1577.37kJ/kg;
水溶液物理性质 无水物和各种水合物,溶在水中后,其物理性质是相同的。现择要列下:
水中溶解度:

水溶液蒸汽压下降:

水溶液沸点上升(在0.1MPa下):

水溶液电导率(25℃) =106×L/C:
=106×L/C:

注:括弧内数字,似表示精度不高。
L:电导率S/cm;C浓度;克分子按 MgCl2计算。
MgCl2计算。
(二)化学性质
除具有6水氯化镁各种化学反应外,还以下两种反应:
电解制金属镁反应 MgCl2→Mg艹+2Cl-,Mg艹+2e-→Mg,2Cl-+2e+→Cl2
与低醇或氨结成复盐的反应。无水氯化镁在低醇中溶解度:

冷却这些溶液,则形成带醇的潮解性加成化合物结晶,如MgCl2·6CH3OH和MgCl2·6C2H5OH。与氨的加成化合物包括MgCl2·6NH3,MgCl2·2NH3。MgCl2·6NH3是无水氯化镁与气体氨,在密闭体系中制成的,或在-30℃下,从MgCl2-NH4C1-H2O体系结晶而成的。MgCl2·2NH3和MgCl2·NH3是由MgCl2·6NH3热分解制成的。
(三)用途
主要用于生产金属镁和化学工业、轻工业、煤炭、建筑等部门。
四、质量标准
我国氯化镁的国家标准(GB 672-78)见表1-1-13。
表1-1-13 我国氯化镁国家标准

我国以制盐苦卤提取氯化钾、溴素后的母液为原料制成的工业用氯化镁,其化学指标见表1-1-14。
表1-1-14 我国工业用氯化镁国家标准(GB 8453-87)

注:规定1mg铂在1L水中所具有的颜色度为1号度。
日本氯化镁的国家标准(试剂)(JIS K8159-75)规定:
感官指标:无色,有苦味,潮解性结晶,易溶于水和乙醇。
化学指标:应符合表1-1-15规定。
表1-1-15 日本氯化镁国家标准(试剂)的化学指标

捷克斯洛伐克、波兰氯化镁的国家标准,见表1-1-16。
表1-1-16 捷克斯洛伐克、波兰氯化镁国家标准

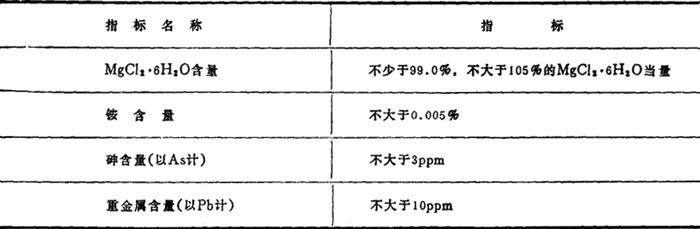
美国联邦电信委员会(F.C.C.)食品级氯化镁标准(MgCl2·6H2O)标准Ⅳ-81见表1-1-17。
表1-1-17 美国联邦电信委员会(F.C.C.)食品级氯化镁(MgCl2·6H2O)标准Ⅳ-81