豌豆
出处:按学科分类—生物科学 农业出版社《植物细胞培养手册》第432页(16901字)
豌豆(2n=24)属蚕豆目豆科蝴蝶花亚科。或大田(干)豌豆收获干种子和饲草或园地(绿)豌豆主要作蔬菜(包括制罐加工)。有些栽培品种可供两用。还是遗传学者,植物学者和生理学者研究最常用的种。原产于地中海和近东,现已分布于全世界温带广大较冷和相对潮湿的区域。干种子豌豆育种主要目标如表19-9。
(一)研究进展
豌豆细胞和组织培养、器官培养、融合和原生质体培养开拓着新可能性,不仅创造更多遗传变异性,也发展着生理、生化和遗传研究,转而增高育种效果(表19-9)。
表19-9 种子豌豆育种主要目标

1.愈伤组织和悬浮培养 豌豆外植体根、茎、叶、子叶、下胚轴、上胚轴、未成熟胚、花芽和叶柄已形成愈伤组织成功。用有利于根、下胚轴片段和下胚轴钩形成愈伤组织的条件,不能使根尖产生愈伤组织。愈伤组织类型视外植体源而异。二个豌豆基因型的根切段产生自硬愈伤组织,而下胚轴切段则是松散黄棕色的。外植体源还决定愈伤组织对物理环境的反应。根和叶愈伤组织的IAA氧化酶和过氧化物酶受γ射线影响,茎愈伤组织的这些酶具有相对抗性。
曾用MS,B5,LS诱导形成愈伤组织,由此建成细胞悬浮培养体。偶有必要改变培养基成分,为从特定组织外植体愈伤组织和悬浮培养体的生长提供最适条件。例如,在生长周期开始时,根和芽细胞培养体对NH4+比NO3-更有利,但在直线生长末期,当培养基碳水化合物告竭时,NO3-成为优势氮源。未成熟胚愈伤组织,以蔗糖为最好碳源,比葡萄糖或果糖相比的话,并在生长周期大部分期间利用很快。在相对高浓度盐类上,未成熟胚愈伤组织生长好。
愈伤组织形成和生长,也有赖于供试荷尔蒙及其浓度。生长素是主要的。一般许多研究选用2,4-D,由于IAA,IPA和IVA无效。Hangarter等(1980)比较几种IAA接合物,测验其生长素活性,发现腺嘌呤接合子最有效,甘氨酸接合物次之,而其它(缬氨酸、亮氨酸、门冬氨酸、苏氨酸、蛋氨酸、苯丙氨酸和脯氨酸)诱导芽形成,但不生根和愈伤组织。但其效果都不如游离IAA。细胞分裂素和GA是愈伤组织生长所不需,与2,4-D组合,增进生长。Tacobsen等(1980)用LS培养豌豆下胚轴,生长素:细胞分裂素=2或以上,诱导愈伤组织形成有效。较高比率(50或100)产生绿色愈伤组织,或由于高浓度细胞分裂素所致。
一般言之,愈伤组织和悬浮培养体生长快,一致性的细胞群体,常用于各种生化和生理研究。曾用豌豆悬浮培养物在有和无诱发剂条件下研究改变了谷氨酸脱氢酶,苹果酸脱氢酶和异柠檬酸脱氢酶活性。同样,也用愈伤组织培养物研究导致细胞分化的形态反应,和一种专化寄生真菌(Ergsiphe polygoni)的毒性繁殖体的大量生产。
豌豆愈伤组织和悬浮培养物虽能忍受高达90μM2,4-D(225μM有毒害),但9μM(许多培养基常用浓度)有丝分裂发生干扰。延长培养后期和末期畸形增高从9到40%,产生多形核和染色体增大。由于培养条件或无整体植株发生的调节控制,产生增殖、无丝分裂、片段和其它畸形。由此可能产生再组核和多倍体性。活体豌豆下胚轴片段中观察到赤道板形成抑制、纺锤体反常、染色体断裂、多倍体性和非整体性。进而由于非同步分裂甚至形成多核细胞。老培养物发现11和12代替14染色体频率增多。
研究2,4-D对豌豆下胚轴片段的影响,在愈伤组织形成期间,发现碱性蛋白质减少,酸性蛋白质增多,这是由于形成2,4-D-蛋白质复合体,而不是蛋白质合成质量的变化。2,4-D与组氨酸蛋白质复合体结果,使非组氨酸蛋白质增多,这可能进一步改变细胞环境,导致细胞分裂期间染色体行为反常。Ahmed与Ghosh(1983)报道2,4-D比NAA和IAA使豌豆悬浮培养体细胞后期反常频率较高。似乎重申着2,4-D导致核反常,这可能与体细胞无性系变异有关联。
最后,愈伤组织形成也有赖于基因型背景。Murashko(1974)筛选42豌豆系和品种和24杂种,发现由于诸系不同,愈伤组织类型的变异量有相当变异。同样,Jacobson等(1980)发现几乎在全部条件下,带有强茎叶娇形的豌豆突变体系,比野生型产生更多的滋生愈伤组织。突变体比亲本系愈伤组织启动更快。
2.分生组织培养
(1)根分生组织 Torry(1954)在培养基增加茎糖、烟酸和硫胺素用量和几种微量元素培养豌豆根尖(0.5mm),包括根冠、分生组织和静止中心。蔗糖浓度影响培养根细胞分裂模式。Rose报道(1982)新离体豌豆分生组织细胞分裂有所推迟,但培养8-12小时后恢复固有速率。Torrey(1961)用Shigamura培养基培养豌豆根切段,细胞倍数性视不同附加物而异。例如,单用YE,CW和KIN结果使以二倍体细胞占优势的,转到四倍体细胞(高达78%)和八倍体细胞(高达10%)。有丝分裂指数作为KIN浓度的函数,从1ppm(4.6μM)的6.9%到5ppm(23.2μM)的12.5%。同样,ABA0.26mg/l(1μM)加强豌豆根尖生长。而乙烯100μl/l使生长下降。
其它变化如增加淀粉含量和降低核酸和氮成,Rost与Sammut(1982)应用蛋氨酸、ethrel和乙烯于完整植株,成功地使有丝分裂频率降低到与离体根尖或受伤或去子叶时诱导发生的水平。他们提出这可能由于损伤引起的乙烯的效果。豌豆根尖分生组织研究见表19-10。
表19-10 豌豆根尖分生组织研究之例

培养的豌豆带静止带根尖广泛作为典型体系,以研究植物的细胞分化。细胞分裂周期体止细胞的存在,提出它们何处停止分裂、何时分化是受予条件的。发现子叶中一种物质运入根,使之停止细胞周期。培养基加过多IAA或不加蔗糖能诱导发生细胞休止状态,虽然这种存在,不是由于碳水化合物饥饿或IAA过多或缺乏。在无蔗糖培养基上有丝分裂停止的,加蔗糖可恢复。
分裂中细胞比休止的多核糖体较多。加蔗糖后再启动的有丝分裂,引起多核糖体增加。它对放线菌酮D不敏感,指出饥饿前形成的mRNA是稳定的,参予多核糖体形成。这与自然发生的静止中心和碳水化合物饥饿细胞中止有丝分裂不同。证实了Webster(1980)的设想,碳水化合物饥饿根尖合成主要蛋白质,虽然中止细胞周期和代谢。这是一种逆景反应。休止中心含有特殊局部性代谢活跃细胞,它担负着这类中心的存在。根尖培养提供揭露休止、分化过程和细胞复制机制在促进分化的潜在状态。
(2)芽分生组织 芽分生组织培养主要目的在于克隆繁殖、生产无病植株和种质长期保存。Kartha等(1974)首次取得成功,将0.2-0.3mm芽尖培养在B5琼脂培养基上,加各种浓度BA和NAA,单用和配合用。0.5μMBA单用或与1μM NAA配合形成芽,在 加1μM NAA诱导生根,再生植株生长成熟。Gamborg等(1974)培养在B5加0.2-5.0μM BA和1μM NAA启动茎尖生芽,生根和生长到成熟开花结荚。
加1μM NAA诱导生根,再生植株生长成熟。Gamborg等(1974)培养在B5加0.2-5.0μM BA和1μM NAA启动茎尖生芽,生根和生长到成熟开花结荚。
分生组织培养再生芽和植株,导致应用于产生无病病毒植株和种质长期保存。Kartha与Gamborg(1978)曾用100以上选系消除了豌豆种子嵌合病毒。
豌豆深冻保存和继之高频率再生(60%以上)。程序包括将离体分生组织予培养在含5%二甲基亚砜(DMSO),冻速0.6℃/min到-40℃,最后储存在液氮(-196℃)中。即使储存二年以上,60%分生组织可再生植株。深冻保存后。经光学和电镜观察成活分生组织,指出靠近顶盖的细胞或细胞群大量成活,活跃生长成株。
Lyndon(1972)根据数学模式,提出豌豆茎尖生长受细胞分裂方向变化的影响比速率为甚。他观察表皮下层细胞,认为这可能与有丝分裂纺锤体的暂时随机性有关。在形成叶原基期间,茎尖顶启动区域看到细胞分裂赤道面的改变。指出芽分生组织为通过诱变而改变生长模式提供潜势。芽分生组织确对外界刺激发生反应。例如,磁场改变(结构和功能)质粒,伤害改变翻译活性。IAA影响转录活性。分生组织水平上遗传修饰,可能担负着如突变体系矮株特性与分生组织内有丝分裂指数较低有关(与野生型相比),另一突变体系的较小细胞由于其分生组织内细胞体积增大和核-核仁比率增大。这些发现似与Young(1983)报道的豌豆叶形态建成模式相符,后者产生具有正常和突变形式组合特性的叶。设想叶结构受顺序决定,由此重复生长和分生组织亚分,和每个分生组织原基受其大小的决定,小原基长成卷须,中等原基小叶,大的穗轴。由于这些特性已归于特定基因,这就为设计具有改良树冠豌豆植株,在分生组织水平上进行遗传修饰的潜势,目的在于有效地截取光线及其转变成光合产物。
3.原生质体培养 曾从豌豆叶、茎尖、根、包括根瘤分离出原生质体。常经程序是用消化酶使细胞壁解体,如纤维素酶(0.25-1.0%)、半纤维素酶(0.5-1.0%),和果胶酶(0.25-0.5%),用适当渗透剂使释放的原生质体稳定(表19-11)。山梨醇、甘露糖醇、葡萄糖和蔗糖(0.3-0.6M)是常用渗透剂。然后经细筛除去组织残屑,离心去除酶。培养前将沉降原生质体洗3-4次。详见表3。有时也曾用蔗糖密度漂浮和相分技术,以取得同源原生质体制品。最近,pthlaate分段梯度离心法从豌豆叶肉组织分离出大量生理活跃的原生质体。
表19-11 豌豆原生质体分离和培养之例

一般把原生质体培养在加渗透剂的B5加4.5μM2,4-D,或5.4μMNAA和9.3μMKIN取得成功。豌豆茎尖原生质体培养,以B5加2-5mML-谷酰胺,0.1-0.5μM,5-10μMKIN和1-5μM2,4-D为宜。0.3M葡萄糖作为渗透剂比山梨醇和甘露糖醇为好。视需要而改变培养培养基和条件以增加效率。除加生长素和细胞分裂素外,加高浓度钙(12mM)和其它成分如烟酸、吡哆醇和几种氨基酸,原生质体成活率可达90%。栽培品种、叶龄,原生质体密度,pH和荷尔蒙影响着其分裂频率如果用3-5叶期幼苗的最上部展开叶培养在0.5-1.0×105/ml密度、pH5.6,分裂最好。豌豆根淀粉含量影响着原生质体产量和成活率。
PEG法是融合原生质体最广泛采用技术。用各种多聚程度的PEG(PEG1250-6000),可使若干植物超越种、属、科障碍不仅融合成功,也能诱导产生异核体,终于分裂产生杂种植株。豌豆原生质体曾用于与若干植物种的原生质体融合(表19-12),并证实了杂种的分裂。技术本身极简单,包括在原生质体混合体中加融合剂(PEG)(装在培养皿中)。培养20-30min后,用滴加法加淋洗溶液,逐步以稀释PEG,然后洗原生质体,在观察体细胞杂种前,认其下沉。Kao等1974用PEG与高pH和高盐溶液结果,能以取得豌豆-大豆杂核体高达35%。它们进一步分裂,形成愈伤组织,但尚未见再生植株的报道(表19-12)。
表19-12 已报道的豌豆与其它植物种原生质体融合之例

*M=叶肉组织,S=悬浮培养细胞;N=根瘤。
原生质体技术除取得新奇杂种外,对了解生理学和遗传学有显着效应。原生质体是具有完整膜的代谢活跃实体,细胞质内表现胞质环流,有再生细胞壁能力。豌豆原生质体曾用于各种研究:细胞学、糖类和氨基酸吸取和运转,光合作用,和细菌吸收。此外,在高速离心下用松弛素B从豌豆原生质体取得无核的原生质体和亚原生质体分离成功,更可用于研究分离体中的基因产物(相当于用大肠杆菌的微细胞,即无染色体DNA的细胞)。
4.英、胚和子叶培养 未成熟豌豆荚培养在简单无机盐营养溶液加5%蔗糖取得成功,主要用于研究发育中种子的营养需要。已知发育中种子能合成赤霉素和细胞分裂素。但是,Kretching等1978未能从种子和荚壁人工培养下合成细胞分裂素,而活体荚内有大量细胞分裂素积存。
发育中和成熟种子中,发现各种生长调节剂,但对发育和种子蛋白质合成的作用知之甚少。培养未成熟胚,已证明了启动豆球蛋白合成及其积存。但是人工培养合成量比活体合成的较高。同样淀粉水平较高,DNA合成水平较低。培养基的渗透剂是关键。1μM和100μMABA,在高渗透性(0.53M)下,使培养的豌豆胚蛋白质含量降低,渗透性较低(0.29M)无影响。最近,Schroeder(1984)证实了当将生长调节剂注射入豌豆荚(开花后2-32天间)时,它们在调节蛋白质合成和积存中有所作用。一般言之,NAA,BA和ABA使子叶总蛋白质含量增多。尤其是NAA与BA配合,增高豆球蛋白含量,单用ABA增高豌豆球蛋白,而清蛋白无影响,GA3对蛋白质总量和成分均无影响。加之NAA∶BA1∶1混合,使清蛋白增加最多,豌豆球蛋白降低。
Millerd等(1975)液培未成熟豌豆子叶,生长数日,合成了大量叶绿素、淀粉、DNA、.RNA和蛋白质,包括储藏蛋白质,豆球蛋白和豌豆球蛋白,好像培养的离体荚中发育中种子一样。培养的子叶也用于研究氮素代谢。人工培养的子叶,5天内合成达16mg蛋白质,当用门冬酰胺或谷酰胺为氮源的话,而用谷氨酸,硝酸盐和脲无效。由于门冬酰胺释放的氨,受蛋氨酸-磺草氨酸(salfoxamine)和氮杂丝氨酸的抑制,这可能经由谷酰胺合成酶和谷氨酸合成酶同化。最近,Chandler等(1983)用离体未成熟子叶(从培养的离体荚取得)进行脉冲标记试验,证实了由于缺硫而降低豆球蛋白合成。
5.叶绿体培养 离体豌豆叶绿体培养,主要供研究离体条件下各种代谢过程。Bloom与Roy(1981)用标记35S-蛋氨酸的叶绿体人工培养,鉴定了RuBP羧化酶大亚单位是最早合成的蛋白质,并提出了这是同型酶集团的早期中间产物。Joussaume与Bourdu(1983)证实了离体叶绿体能在含有光合作用重要物质培养基长期生存,pH7.6,低光强(2-5Watts.m-2·s-1),间歇照光(15min光与15min暗)。这是几类研究的理想体系,如淀粉代谢、盐碱影响、衰老、渗透压逆景对叶绿体结构和功能影响,以及翻译后细胞质合成的多肽的运转。
6.再生 曾从豌豆茎尖、下胚轴、胚、未成熟叶、和茎尖分生组织(表19-13)再生成功。叶肉和根分离取得原生质体并培养,但未获再生植株。Gamborg等(1974)从培养在B5加0.2-5μM BA和1μMNAA的茎尖愈伤组织取得多芽,有些长至成熟。
表19-13 离体培养豌豆再生植株

幼合子胚和发芽种子下胚轴愈伤组织再生植株。愈伤组织诱导用MS加10.7μM NAA+4.4μM BA,用MS加1.1μM IAA和22.2μM BA生芽。愈伤组织生长2月后,6/16系生芽,生长6月后,只有2系能生芽。当用相同二系再测验,只见从已存在的分生组织出现,而不是愈伤组织产生的。是否就地分化成芽,尚待证实,它们有可能从予决定的分生组织或分生组织区域产生的。
豌豆茎尖分生组织培养再生植株也取得成功。把0.2-0.3mm分生组织培养在B5单加0.5μMBA或与1μM NAA配合取得了多芽。培养3周后,芽长2厘米时,移入 加1μM NAA诱导生根。最后长成植株。此种技术为消除豌豆种子带嵌镶病毒提供途径,以及为长期保存豌豆种质的深冻保存建立措施。
加1μM NAA诱导生根。最后长成植株。此种技术为消除豌豆种子带嵌镶病毒提供途径,以及为长期保存豌豆种质的深冻保存建立措施。
深冻保存的豌豆叶原基有生活力,能进行分裂和分化,导致用未成小叶再生技术。切取小小叶远端2/3处(0.7-2.0mm),培养在MS盐类,B5维生素,10μM NAA,10μM BA,40%外植体产生多芽,然后转入生根培养基(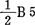 加1μM NAA),3月后形成完整植株。Rubluo等(1984)观察再生株后代保持遗传稳定性。除基因型差异外,人工培养环境的物理条件,是再生成功的关键。
加1μM NAA),3月后形成完整植株。Rubluo等(1984)观察再生株后代保持遗传稳定性。除基因型差异外,人工培养环境的物理条件,是再生成功的关键。
豌豆离体培养再生植株虽已成功,但对器官建成、胚胎发生、分化和脱分化的复杂性了解很有限。Mykhailov与Bezsonova(1971)观察到愈伤组织形成程度与分化不定根间和根与芽形成间的反相关。认为这是由于愈伤组织细胞崩解和干扰遗传信息所致。未分化细胞当启动某些形态的和功能的特性时,分化前似乎进行生化性质的微妙变化。采用纤维放射自显影技术,Van′t Hof与Bjerknes(1977)观察到豌豆某些核酸复制起点(或是转录活动),胚原细胞内是休止的,分化细胞是活跃的。最近,指出各种细胞周期的缩合染色质含量的变化,与豌豆节分化有关。
改变基因型、培养基和条件和荷尔蒙已成功地取得器官形成或胚胎发生,最后植株再生。基因型对器官建成能力有基本重要性。采用外来冲击或刺激,如低温处理(-196℃)种子,结果使离体豌豆子叶愈伤组织发育增进和根再生。豌豆愈伤组织培养基也重要,如LS生长很快,Heller培养基很少生长与器官建成。培养基成分,磷酸盐似乎影响酸性磷酸酶,高浓度时,抑制可溶和束缚酸性磷酸酶二者的合成,正常细胞中位于圆球体和细胞壁内。酸性磷酸酶包括在愈伤组织分化中,也受培养基中GA的影响。再者,10μM IAA抑制豌豆茎切段生根,由于IAA-诱导乙烯形成。
(二)培养程序
1.种子发芽
(1)豌豆种子浸入70%乙醇2min,表面消毒,继之用1.2%次氯酸钠(20%商品漂白粉含次氯酸钠6%),放在旋转振荡器(150-200rpm)20min,用无菌蒸馏水淋洗4-5次。
(2)将种子移入100ml螺旋帽玻璃瓶,装湿棉花(每瓶6-7粒种子)。除去破壳种子。用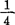 Hoagland溶液代换蒸馏水浇湿棉花较好。
Hoagland溶液代换蒸馏水浇湿棉花较好。
(3)把瓶培养在26℃,3-4天后,视种子情况而定,取发芽种子备用。
2.愈伤组织和悬浮培养体
(1)取无菌幼苗长0.5cm根、下胚轴或芽,接种在B5加0.2%水解酪蛋白和4.5μM2,4-D,0.6%琼脂固化。另一方法,用MS加10.7μM NAA与4.4μM BA。用塑料培养皿、三角瓶或无菌塑料瓶均可。
(2)暗培,26℃,低光强。
(3)每月将愈伤组织转入新鲜培养基保持。
(4)将愈伤组织移入悬浮培养液,装在欧氏三角瓶中(20-25ml培养基装入125ml瓶,或40-50ml装入250ml瓶)。另一方法,把0.5cm下胚轴或根切段10-15,放入10ml液体培养基,装在50ml瓶中。
(5)放在旋转振荡器上,150rpm,连续光照。
(6)继代早期,除去部分废培养基,加入新鲜培养基,从1∶1逐渐稀释到1∶4。4-6周形成悬浮培养体。
3.芽分生组织培养和植株再生
(1)种子发芽后4-5天,无菌切取茎尖分生组织顶盖(带一对叶原基),约0.2-0.3mm(在扩大镜下进行),接种在培养管中,装B5(pH5.7)加0.5μM BA或与1μM NAA配合,0.6%琼脂固化。也可用塑料培养皿。
(2)分生组织培养在生长箱内,20℃日、15℃夜,相对湿度60%,冷白荧光(40wm-2),16小对光周期。
(3)一个月后,取个别芽2cm,再培养在 加1μM NAA,诱导生根。
加1μM NAA,诱导生根。
(4)带根再生株移入钵中生长成熟。开始时必须把再生株放在高湿条件下。
4.未成熟叶培养和植株再生
(1)用0.6%次氯酸钠(10%商品漂白粉含6%次氯酸钠)表面消毒3日龄幼苗10min,旋转振荡150rpm,用无菌蒸馏水洗3-4次。
(2)扩大镜下无菌解剖茎尖,从第二、三顶叶取出黄白色未成熟小叶。不用3日龄以上幼苗。
(3)切取其远端约2/3,每瓶(100ml)接种2-4外植体,装有30ml培养基,MS大元素和微量元素盐类,B5维生素,3%蔗糖,0.8%琼脂,pH5.8,附加0.1μM NAA和10μM BA。
(4)用石蜡膜MR封口,放入培养箱20℃相对湿度70%,16h光照,光强40wm-2荧光灯和白炽灯,8h黑暗。
(5)一个月后形成愈伤组织,45天内开始产生原基结构。培养45-90天形成芽簇。
(6)视需要切取个别芽,再培养在 加1μM NAA诱导生根,或继代在生芽本身培养基上,继续生长。
加1μM NAA诱导生根,或继代在生芽本身培养基上,继续生长。
(7)再生植株生长成熟,如前述。
5.分生组织深冻保存和继而复活
(1)发芽后(4-5天),无菌切取茎尖分生组织(0.4-0.5mm)。分生组织顶盖应带有部分原形成层组织,生存较好。除非要消除病毒,叶原基可不一定切除。
(2)取20个分生组织放入125ml瓶,装30mlB5加0.5μM BA,0.6%琼脂固化,附加5%(v/v)二甲基亚砜(DMSO),预培养,放在生长箱中,20℃日,15℃夜,16h光照,光强30-40w·m-2。
(3)把瓶放在冰浴中2h,取分生组织转入离心管,装10mlB5,在冰浴中预冷。
(4)加等容积冷B5含10%(v/v)DMSO,30min,加平衡时间10min。
(5)把20个分生组织分装入1.0ml溶液中的深冻小管内,火焰封口,留一个作放热电偶用。
(6)用未封口小管,插入热电偶,把所有小管放入预冷(0℃)结冰箱内,使之与热电偶小管保持等距离。
(7)以0.6℃分钟速度继续降温,直到-40℃,恒常控制此过程。然后把小管储存于液氮储藏库(-196℃),浸入状态。
(8)为了使之复活,取出小管,放入37℃水浴速溶90s,立即移入冷浴中。
(9)打开小管,将内含物倒入离心管,放在冰浴中。逐步加6体积B5培养液,30min定期摇动。
(10)取出分生组织,用B5洗4次,培养法见上述芽和根形成和再生株生长成熟。
6.原生质体分离和培养(叶肉)
(1)至少在分离叶原生质体前30h,将从5-7周龄温室生长豌豆植株最幼6-10节的芽切段放在黑暗中。
(2)将叶浸入装70%乙醇的100×15mm培养皿表面消毒2min,用与酶溶液渗透压和pH相同溶液洗2-3次。
(3)用一对细镊子撕去下表皮。把叶切成小块,用0.5-0.8g叶组织放入5ml酶溶液,含有无机盐类,葡萄糖和MES,用0.2N KOH调整pH到所需程度,0.3M山梨醇和0.3M甘露糖醇作渗透剂,和0.2%Onozuka R10(纤维素酶)和0.2%Driselase(纤维素酶、脱盐的),Rhozyme HP150(半纤维素酶)和0.1%果胶酶,pH6.8,装在15×100mm培养皿中。
(4)用石蜡膜封培养皿边后,铝箔包以防蒸发和光,培养在振荡器上(50rpm)12-18h(过夜)。
(5)通过60-70μm筛(不锈钢或尼龙筛)除去残屑,把原生质体悬浮体装进离心管,离心100×g3min。
(6)用巴斯德吸移管除去上清液,轻轻把原生质体沉降物悬浮在10ml培养液中。
(7)离心和再悬浮重复洗2次。
(8)最后,把原生质体再悬浮在mll培养液中,培养在60×15mm培养皿中,加培养基5-12滴,每滴0.2ml。密度不应超过104原生质体/ml。
(9)石蜡膜封培养皿,温室下培养,放在湿塑料容器内,漫散光。在分离后最初2周内,每隔4-7天,在这些滴上加新鲜培养基,较为有利。
(三)展望
豌豆细胞融合或某种细胞转化,由于人工培养的或操作的细胞,尚未能再生成功,还未能成为常规育种的另一方式。花粉辐射不仅产生高产系,并有可能把母性信息很快转移给子代,以及其比例高。花粉(花药)培养产生单倍体,不仅能缩短轮回杂交时期,增高遗传差异和利于分离出新奇突变体。
Gifford等(1984)提出增高遗传产量潜力,包括改进下列三种过程的效率:(1)叶截取的光,(2)辐射能(日光)转变成光合产物,和(3)光合同化物在经济产量与营养体间的分配。由此可知,有需要鉴别各种生理的和形态特性间关系,评价其农艺关系,开发用作选择特性的可能性。
光合自养培养物,不仅是光合作用基础研究的理想材料,能用生物技术以诱导和选择突变体,原生质体融合标志,选择除莠剂抗性。豌豆光合自养细胞培养体尚待研究。
组织培养肯定地有助于创造新遗传变异性。分生组织和未成熟小叶的人工培养诱变,继之选择,由于它们可能产生多芽,这种过程能以应用。
在现有品种基础上,引导“无叶”或“半无叶”特性,可能解决豆苗差和树冠不理想问题。但其缺点是干物质积累常比正常叶品种迟7天。虽然其RuBP羧化酶活性与正常叶品种相似。最近研究,Masuko等(1983)分离和鉴定了dihydromaleimide及其糖苷是矮株豌豆的设想的生长抑制剂。Petrova与Gudkov(1983)报道了早熟豌豆品种根分生组织细胞,由于其予合成时期的差异,其分裂比迟熟品种较快。这些发现指出上述特性可用遗传操作加以改进,组织培养技术可用于鉴定和把这些性状渗入理想豌豆植株。此外,芽分生组织可为改变叶型和株型提供新潜力,以培育改进的树冠与高产品种相竞存。
除改进产量外,种子蛋白质含量和质量是豌豆育种的另一目标。胚培养可用于测验各种生化合成途径间的相互关系,和测定遗传操作的可行性。至于蛋白质质量以增高含硫氨基酸很重要。豌豆种子含清蛋白和球蛋白,后者由豆球蛋白和豌豆球蛋白所组成。前者含硫氨基酸较后者为高,可使之增高较为有利。另一途径是增高含硫氨基酸更多的清蛋白。近年来运用人工培养和活性系统,证实了若干生长调节剂对调节种子生长和蛋白质成分的作用。分离豆球蛋白的mRNA,从mRNA人工合成蛋白质,豆球蛋白合成中cDNA的克隆化和顺序化,增进了了解豌豆蛋白质合成的分子学过程。Boulter(1983)指出采用转录的遗传操作,可能完成增高蛋白质含量,运用重组DNA技术学可能改进蛋白质质量,由于只有少数贮藏蛋白质基因。人工培养技术学是达到这种目标的主要措施。
培育抗病、虫特性是改良作物的另一目标。目前尚无抗和免疫豌豆主要病害的品种。Kartha等采用人工培养取得了无病毒植株。并能根据寄主-病原菌关系研究抗病机理。在细胞水平上诱变或原生质融合体细胞杂交以诱导产生抗病性。目前可采用芽分生组织和未成熟小叶诱导取得成果,由于它们有可能产生多芽。最近,Gamborg等(1983),Christianson等(1983)诱导大豆体细胞胚胎发生成功,及其有关的形态反应,表明着前途乐观。
【参考文献】:
〔1〕Boulter,D.and O.J.Crocomo 1979 Plant cel lculture implications::Legumes.In∶Plant Cell and Tissue Culture:Principles and Applications(W.R.Sharp,.VO.Larsen,E.F.Paddock,V.Raghavan,eds.)pp.615-631,Ohio State Univ.Press Columbus.
〔2〕Evans,A.M.and H.E.Gridley 1979 Prospects for the improvement of protein and yield in food legumes.Current Adv.Plant Cci.32∶1-17.
〔3〕Purseglove,J.W.1969 Tropical crops dicotyledon 1.Longmans,New York.
〔4〕Zaumeyer,W.J.and H.R.Thomas 1957 A monographic study of bean diseases and methods for their control.Technical Balletin 868,U.S.Dept.Agric.
〔5〕Cheng,T.Y.,H.Saka and T.H.Voqui-Dinh 1980 Plant regene ration from soybean cotyledoary node segments in culture.Plant Sei.lett.19∶91-99.
〔6〕Christianson,M.L.and D.A.Warnick 1983 Competence and dete rmination in the process of in vitro shoot organogenesis.Dev.Biol.95∶288-293.
〔7〕Christianson,M.L.and D.A.Warnick 1984 Phenocritical times in the process of in vitro shoot organogenesis.Dev.Boil.10∶382-390.
〔8〕CroSS,J.W.and W.R.Adams 1983 Phenvlic levels and embrgogenic potential in carrot cultures.Plant Physiol.72∶546.
〔9〕Kratochwil,K.1983 Embryonic induction.In∶Cellular Interactions and Development∶Molecular Mechanisms.K.M.Yamada.ed.Wiley,New York,pp.99-122.
〔10〕Ratner,V.A.and R.N.Tetthuteav 1978 Simplest genetic systems controlling ontogenesis∶Organization principles and models of their function.Pcog.Theor.Biol.5:81-127.
〔11〕Rendel,J.M.1967 Canalization and gene confrol Logos Press,Ltd.London.
〔12〕Riggs,D.S.1970 Cont rol Theory and Physiological Feedback Mechanisms.Williams and Wilkins Co.,Baltimore.
〔13〕Sneath,P.H.A.and R.R.Sokal 1973 Numerical Taxonomy:The Principles and Practice of Numerical Classifications.W.H.Freeman,San Francisco.
〔14〕Tyson,J.J.and H.G.Othmer 1978 The dynamics of feedback control circuits in biochemical pathways.Progress in Theor.Biol.5:1-62.
〔15〕Yusufov,A.G.1982 Origin and evolution of the phenomenan of regeneration in plant(problem of evolution ontogenesis).Usp.Soyrem.Biol.93∶89-104.
〔16〕Bajaj,Y.P.S.,A.K.Ram,K.S.Labana and H.Singh.1981 Regeneration of genetically variable plants from anther-derived callus of Arachis hypogaea and A.villosa.Plant Sci.Lett.23∶35-39.
〔17〕Bajaj,Y.P.S.,P.Kumar,M.M.Singh and K.S.Labana 1982 Interspecific hybr-idazation in the genus Arachis through embryo culture,Euphytica 31∶365-370.
〔18〕Smartt,J.and W.C.Gregory 1967 Interspecific cross compatibility between the cultivated peanut,Arachis hypogaea L.and other members of the genus Arachis.Oleagineux 22∶455-459.
〔19〕Spielman,I.V.,A.P.Burge and J.P.Moss 1979 Chromosome loss and meiotic behaviour in interspecific hybrids in the genus Arachis L.and their implications in breeding for disease resistance.Z.Pflanzenzuecht.83∶236-250.
〔20〕Wilson,C.T.1973 Peanut∶ Culture and Uses.American Peanut Research Education Association Stillwater,Oklahoma.
〔21〕Kartha,K.K.1981 Meristem culture and cryopreservation-Methods and applications.In∶Plant Tissue Culture(T.A.Thorpe,ed.)pp:181-211,Academic Press,New York.
〔22〕——1982 Cryopreservation of germplasm using meristem and tissue culture。 In:Application of Plant Cell and Tissue Culture to Agriculture and Industry。(D.T.Tomes,B.E.Ellis,P.M.Harney, K.J.Kartha,and R.L.Peterson,eds.)pp.139-161,Univ.of Gulph,Ontario.
〔23〕Mroginski,L.A.and K.K.Kartha 1984 Tissue culture of legumes for crop improvement.In:Plant Bteeding Reviews,vol.2(J.Janicked.)pp.215-264.AVI Pllblishing,Westport,Corn.
〔24〕Wetter,L.R.and F.Constabel(eds.)1982 Plant Tissue Culture Methods.Nationai Resea rch Council of Canada,Saskatoon.