蛋白质的测定——微量凯氏定氮法(GB/T 14771—1993)
出处:按学科分类—工业技术 中国轻工业出版社《焙烤工业实用手册》第583页(2716字)
1.原理
利用硫酸及催化剂与食品试样一同加热消化,使蛋白质分解,分解的氨与硫酸作用,形成硫酸铵留在酸液中。将消化液碱化、蒸馏,使氨游离,随水蒸气蒸出,被硼酸吸收。用盐酸标准溶液滴定所生成的硼酸铵,由所消耗的盐酸标准液的量,乘以换算系数,即可计算出蛋白质的含量。
本法适用于各类食品中蛋白质的测定。
2.试剂
(1)硫酸铜。
(2)硫酸钾。
(3)硫酸。
(4)4%硼酸溶液。
(5)混合指示剂:1份0.1%次甲基蓝乙醇溶液与2份0.1%甲基红乙醇溶液临用时混合。
(6)40%氢氧化钠溶液。
(7)0.1mol/L盐酸标准溶液。
3.仪器
微量定氮仪(如图4-2-1)。
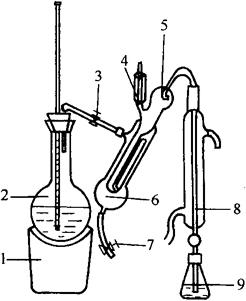
图4-2-1 微量定氮仪
1-电炉 2-水蒸气发生瓶 3-螺旋夹 4-小玻杯及玻璃塞 5-反应室 6-反应室外层 7-橡皮管 8-冷凝管 9-蒸馏液接收瓶
4.操作方法
(1)样品处理:精密称取0.5~5.0g固体样品或2~5g半固体(精确称至0.001g)或吸取10~20mL液体样品(相当于氮30~40mg),移入干燥的100mL或500mL定氮瓶中,避免黏附在瓶壁上,加入0.4g硫酸铜、10g硫酸钾及20mL硫酸及数粒玻璃珠,稍摇匀后于瓶口放一小漏斗,将瓶以45°角斜支于有小孔的石棉网上。小心加热,待内容物全部炭化,泡沫完全停止后,加强火力,并保持瓶内液体微沸,至液体呈蓝绿色澄清透明后,再连续加热0.5h。取下放冷,小心加水20mL。放冷后,移入100mL容量瓶中,并用少量水洗凯氏烧瓶,洗涤液并入容量瓶中,再加水至刻度,混匀备用。取与处理样品相同量的硫酸铜、硫酸钾、硫酸做试剂空白试验。
(2)按图4-2-1装好定氮装置,于水蒸气发生瓶内装水至约2/3处,加甲基红指示剂数滴及数毫升硫酸,以保持水呈酸性,加入数粒玻璃球以防爆沸,加热煮沸水蒸气发生瓶内的水。
(3)向接收瓶内加入10mL 4%硼酸溶液及混合指示剂1滴,并使冷凝管的下端插入接受瓶的液面下,吸取10.0mL样品消化稀释液由小玻璃杯流入反应室,并以10mL水洗涤小玻杯使流入反应室内,塞紧小玻杯的棒状玻塞。将10mL 40%氢氧化钠溶液倒入小玻杯,提起玻塞使其缓缓流入反应室,立即将玻塞盖紧,并加水于小玻杯以防漏气。夹紧螺旋夹,开始蒸馏。蒸汽通入反应室使氨通过冷凝管而进入接收瓶内,蒸馏5min,移动接收瓶,使冷凝管下端离开液面,再蒸馏1min。然后用少量水冲洗冷凝管下端外部。洗液并入接收瓶中,取下接收瓶,以0.1mol/L盐酸标准液滴定收集液至刚出现紫红色为终点。
同一试样做两次平行试验,同时吸取10.0mL试剂空白消化液做试剂空白。
5.计算
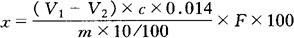
式中 x——样品中蛋白质的含量(%);
V1——样品消耗盐酸标准溶液的体积(mL);
V2——试剂空白消耗硫酸或盐酸标准溶液的体积(mL);
c——盐酸标准溶液的量浓度(mol/L);
0.014——1mol/L盐酸标准溶液1mL相当于氮的克数;
m——样品的质量(体积)[g(mL)];
F——氮换算为蛋白质的系数。蛋白质中的氮含量一般为15%~17%,按16%计算乘以6.25即为蛋白质,乳制品为6.38;面粉为5.70;玉米、高粱为6.24;花生为5.46;米为5.95;大豆及其制品为5.71;肉与肉制品为6.25;大麦、小米、燕麦、裸麦为5.83;芝麻、向日葵为5.30。计算结果精确至小数点后第二位。
6.注意事项
(1)消化如不易得到澄清透明的溶液,可将定氮瓶放冷后,缓缓加30%过氧化氢2~3mL,促进氧化。
(2)如取样量大,干试样超过5g,可按每克试样5mL的比例增加硫酸用量。
(3)若样品含脂肪或糖较多时,消化时易产生大量泡沫并外溢,可加入少量辛醇或液体石蜡消泡。
(4)所用试剂应用无氨水配制。用甲基红指示剂,调节蒸馏水发生器中的水为酸性后,蒸馏出即为无氨蒸馏水。
(5)蒸馏操作加入氢氧化钠溶液前,一定要将整个装置的连接密封好,以免氨逸出。使结果偏低。
(6)硼酸吸收液的温度不应超过40℃,否则氨吸收减弱,造成损失,可置于冷水浴中。
(7)蒸馏完毕,应先将锥形瓶下降,使馏出管尖端离开液面,然后再撤离热源,以免倒吸。
7.允许差
同一样品两次测定值之差,当蛋白质含量小于1%时,不得超过平均值的10%;当蛋白质含量大于1%时,每100g样品不得超过0.5g。