主要有害气体的治理技术
出处:按学科分类—工业技术 企业管理出版社《工程师手册》第1139页(4315字)
工业生产中排出的有害气体种类很多,主要有二氧化硫、三氧化硫、硫化氢、硫醇、一氧化氮、二氧化氮、氨、一氧化碳、碳氢化物等。其中排放最多、影响较大的是硫氧化物和氮氧化物。
1.硫氧化物治理
硫氧化物是大气的主要污污染物之一。它来自矿物燃料的燃烧、金属冶炼、石油炼制、硫酸生产和硅酸盐制品的焙烧等过程。硫氧化物包括二氧化硫(SO2)和三氧化硫(SO3),通常燃烧形成的废气中三氧化硫的浓度约占硫氧化物总量的0.5~5.0%。目前,二氧化硫治理技术有排烟脱硫、高烟囱排放和燃料脱硫。现将排烟脱硫技术介绍如下。
排烟脱硫的方法目前已有80余种。按使用的吸收或吸附剂形态和过程原理,分为干法和湿法两大类。
(1)干法
用固态吸附剂或固体吸收剂去除烟气中的SO2的方法。干法排烟脱硫效率低,副产物处理麻烦,脱硫装置庞大,投资费用也高,因此,此法虽然较早出现,但进展缓慢。
①石灰粉吹入法:是将石灰石(CaCO3)粉末吹入燃烧室内,在1050℃高温下,CaCO3分解成氧化钙(CaO),并和燃烧气体中的SO2反应生成石膏(COSO4)。此法脱硫效率为40~60%。
②活性炭法:利用活性炭的活性和较大的比表面积,使烟气中的SO2在活性炭表面上与氧及水蒸气反应生成硫酸。
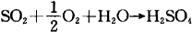
采用不同的脱吸方法可回收稀硫酸、浓SO2或浓H2SO4。用水脱吸可回收10~20%的稀H2SO4;用高温惰性气体脱吸可得10~40%的SO2或浓H2SO4,因水蒸气脱吸可得70%的SO2。
③接触氧化法:此法与工业接触法制酸一样,是以硅石为载体,以五氧化二矾或硫酸钾等为催化剂,使SO2氧化制成无水或78%的硫酸。此法由于高温操作,操作费用和建设费用都较高,但此法在技术上比较成熟,国内外对高浓度SO2烟气治理多采用此法。
(2)湿法
是用液态吸收剂吸收烟气中SO2的方法。湿法排烟脱硫装置具有投资少、操作及维护容易、反应快、脱硫效率高等优点,近年来兴建的脱硫装置多采用湿法。湿法中按吸收剂不同,主要有氨法、钠法、石灰-石膏法、镁法以及催化氧化法等。
①氨法:用氨水(NH3·H2O)为吸收剂吸收烟气中的SO2,其中间产物为亚硫酸铵〔(NH4)·SO3〕和亚硫酸氢铵〔NH4HSO3〕。
2NH3·H2O+SO2→(NH4)2SO3+H2O
(NH4)2SO3+SO2+H2O→2NH4HSO3
此法在吸收液中加入NH3·H2O,使其中NH4HSO3转化成(NH4)2SO3,然后再经空气氧化、浓缩结晶可得硫酸铵。
2(NH4)2SO3+O2→2(NH4)2SO4
在上法回收的(NH4)2SO4溶液中再添加石灰或石灰乳浊液,经反应后可得石膏,反应生成的NH3用水吸收重新返回作吸收剂。
(NH4)2SO4+Ca(OH)2→CaSO4·2H2O+2NH3
(NH4)2SO4+CaCO3+H2O→CaSO4·2H2O+2NH3+CO2
将(NH4)2SO3溶液加热分解,可制得浓的SO2溶液。再以H2S还原,即可得到单体硫。
(NH)2SO3→2NH3+SO2+H2O
SO2+2H2S→3S+2H2O
②钠法:用氢氧化钠、碳酸钠或亚硫酸钠水溶液吸收烟气中的SO2。该法具有吸收速度快,管路及设备不易堵塞等优点,故应用较广泛。
2NaOH+SO2→Na2SO3+H2O
Na2CO3+SO2→Na2SO3+CO2
Na2SO3+SO2+H2O→2NaHSO3
将含有Na2SO3的吸收液经浓缩、结晶和脱水后可回收Na2SO3晶体。或将含有Na2SO3的吸收液(将NaHSO3全部转化成Na2SO3)直接送造纸厂代替烧碱蒸煮纸浆,这是一个综合利用的好方法。将吸收液中的NaHSO3加热分解后可获得高浓度SO2,如再经接触氧化后即可制得硫酸,也可用H2S还原制成单体硫。如在含有NaHSO2的吸收液中加入石灰或石灰乳浊液使NaHSO3生成Na2SO3和CaSO3,再经空气氧化可回收石膏CaSO4。回收石膏也可用石灰石、生石灰(CaO)或消石灰(Ca(OH)2)的乳浊液直接吸收烟气中的SO2,吸收过程生成的CaSO3经空气氧化后可得石膏,此法所用吸收剂价廉易得,回收的大量石膏可作建筑材料,因此被国内外广为采用。
③氧化镁法 用pH值为8~8.5的5%MgO乳浊液回收烟气中的SO2。吸收过程中生成的MgSO4·7H2O和MgSO3·6H2O的晶体与焦炭一起在1000℃下加热分解得到SO2和MgO。MgO用水调制成乳浊液循环使用;高浓度的SO2可用作制H2SO4和单体S。
2.氨氧化物治理
从燃烧装置排出的氮氧化物主要以NO形式存在。NO比较稳定,在一般条件下,它的氧化还原速度较慢。从排烟中去除氮氧化物的过程简称“排烟脱氮”。它与“排烟脱硫”相似,也需要用液态或固态的吸收剂或吸附剂来吸收或吸附氮氧化物以达到脱氮目的。由于排烟中的氮氧化物主要是NO,因此在用吸收法脱氧之前需将NO进行氧化。目前排烟脱氮方法有非选择性催化还原法、选择性催化还原法和吸收法等。
(1)非选择性催化还原法
是以一氧化碳、氢、甲烷等还原性气体作为还原剂,用元素铂、钯或用钴、镍、铜、铬、锰等金属氧化物为催化剂,在400~800℃,将氮氧化物还原成氮气,同时有部分还原剂与烟气中过剩的氧发生燃烧反应形成水和二氧化碳,并放出大量热。此法效率高,但需耗费大量还原剂。
(2)选择性催化还原法
是用元素铂或用铜、铁、钴、钒等氧化物为催化剂,以氨、硫化氢为还原剂,有选择性地和排放废气中NOx反应,反应温度为200~450℃(以H2S为还原剂时反应温度为120~150℃)。此法还原剂消耗仅为非选择性还原法的1/5~1/4。我国应用非贵金属钼、铜铬系和铁铬系作催化剂,选择温度的范围为100~120℃。
(3)吸收法
①碱液吸收法 此法可同时除去烟气中的SO2。当烟气中NO/NO2=1(N2O3)时,碱液的吸收速度比只有1%的NO时的吸收速度大约加快10倍。通常采用30%NaOH溶液或10~15%的Na2SO4溶液作为吸收液。其主要反应为:
2MOH+N2O3→2MNO2+H2O
2MOH+2NO2→MNO2+MNO3+H2O
式中M代表Na+、K+、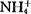 、Ca+等。
、Ca+等。
②熔融盐法 是以熔融状态的碱金属或碱土金属盐类吸收烟气中的NXx的方法。此法也可同时除去烟气中的SO2,其主要反应为:
MCO3+2NO2→MNO2+MNO2+CO2
2MOH+4NO→N2O+2MNO2+H2O
4MOH+6NO→N2+4MNO2+2H2O
式中M代表Li+、Na+、K+、Rb+、Cs+、Sr2+、Ba2+等。
③硫酸吸收法 此法基本上与铅室法制造硫酸反应相似,也可同时除去烟气中的SO2。
④氢氧化镁吸收法 用Mg(OH)2脱出烟气中SO2和NOx。主要反应为:
Mg(OH)2+SO2→MgSO3+H2O
Mg(OH)2+NO+NO2→Mg(NO2)2+H2O
3.有机污染物治理
有机污染物的净化方法如表7.4.5-1所示。
表7.4.5-1 有机污染物的净化方法

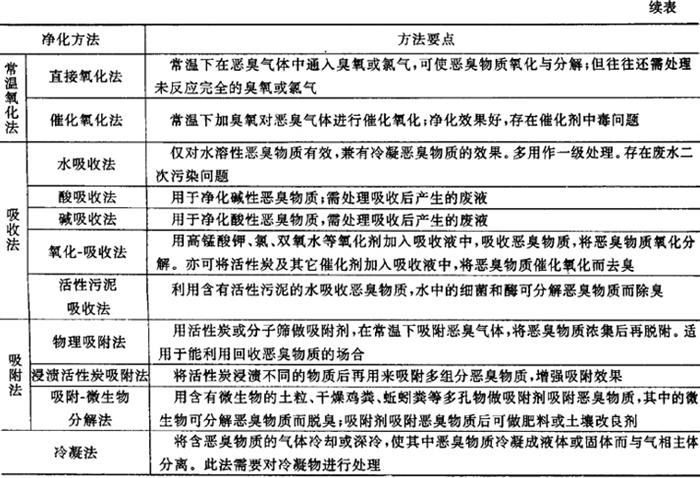
4.恶臭物质治理
恶臭物质的净化方法见表7.4.5-2。
表7.4.5-2 恶臭物质的净化方法